„Tetraethylzinn“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
typo |
JWBE (Diskussion | Beiträge) KKeine Bearbeitungszusammenfassung |
||
| Zeile 16: | Zeile 16: | ||
| Dampfdruck = 1,6 [[Pascal (Einheit)|mbar]] (20 °C)<ref name="GESTIS" /> |
| Dampfdruck = 1,6 [[Pascal (Einheit)|mbar]] (20 °C)<ref name="GESTIS" /> |
||
| Löslichkeit = praktisch unlöslich in Wasser<ref name="GESTIS" /> |
| Löslichkeit = praktisch unlöslich in Wasser<ref name="GESTIS" /> |
||
| Brechungsindex = 1,473 |
| Brechungsindex = 1,473 (20 °C)<ref name="Sigma" /> |
||
| Quelle GHS-Kz = <ref name="GESTIS" /> |
| Quelle GHS-Kz = <ref name="GESTIS" /> |
||
| GHS-Piktogramme = {{GHS-Piktogramme|02|06|09}} |
| GHS-Piktogramme = {{GHS-Piktogramme|02|06|09}} |
||
| Zeile 51: | Zeile 51: | ||
== Verwendung == |
== Verwendung == |
||
Tetraethylzinn wird als Reaktionsgas im [[Chemische Gasphasenabscheidung|CVD-Verfahren]] zur Herstellung funktioneller Schichten und leitfähiger transparenter Schichten verwendet. Es wurde auch als [[Pestizid]], [[Fungizid]] und [[Bakterizid]] verwendet.<ref name="Metall">{{Literatur | Autor = Werner Baumann,Bettina Herberg-Liedtke | Titel = Chemikalien in der Metallbearbeitung | Verlag = Springer |
Tetraethylzinn wird als Reaktionsgas im [[Chemische Gasphasenabscheidung|CVD-Verfahren]] zur Herstellung funktioneller Schichten und leitfähiger transparenter Schichten verwendet. Es wurde auch als [[Pestizid]], [[Fungizid]] und [[Bakterizid]] verwendet.<ref name="Metall">{{Literatur | Autor = Werner Baumann, Bettina Herberg-Liedtke | Titel = Chemikalien in der Metallbearbeitung | Verlag = Springer | ISBN = 978-3-540-60094-7 | Jahr = 1995 | Online = {{Google Buch | BuchID = K26JPOZHtz0C | Seite = 1467 }} | Seiten = 1467}}</ref> |
||
Es wurde in den 1920er Jahren kurzfristig für den Einsatz als [[Antiklopfmittel]] für [[Ottokraftstoff]]e untersucht, jedoch schnell durch das effektivere [[Tetraethylblei]] ersetzt.<ref name="Vaclav Smil Distinguished Professor University of Manitoba">{{Literatur | Autor = Vaclav Smil Distinguished Professor University of Manitoba | Titel = Transforming the Twentieth Century : Technical Innovations and Their |
Es wurde in den 1920er Jahren kurzfristig für den Einsatz als [[Antiklopfmittel]] für [[Ottokraftstoff]]e untersucht, jedoch schnell durch das effektivere [[Tetraethylblei]] ersetzt.<ref name="Vaclav Smil Distinguished Professor University of Manitoba">{{Literatur | Autor = Vaclav Smil Distinguished Professor University of Manitoba | Titel = Transforming the Twentieth Century : Technical Innovations and Their Consequences | Verlag = Oxford University Press | ISBN = 0-19-803775-9 | Jahr = 2006 | Online = {{Google Buch | BuchID = XvB1ZcsrDFAC | Seite = 171 }} | Seiten = 171 }}</ref> |
||
== Sicherheitshinweise == |
== Sicherheitshinweise == |
||
Die Dämpfe von Tetraethylzinn können mit Luft ein explosionsfähiges Gemisch ([[Flammpunkt]] 53 °C) bilden.<ref name="GESTIS" /> Im Körper wandelt es sich zu dem toxischeren [[Triethylzinn]] um.<ref name=cremer>Jill E. Cremer (1958), "The biochemistry of organotin compounds. The conversion of tetraethyltin into triethyltin in mammals". In: ''[[Biochem J.]]'' volume 68, issue 4, S. 685–692, {{PMC|1200418}}.</ref> Diese Verbindung wurde 1953/54 als neurotoxische Substanz bekannt, als in Frankreich 110 Todesfälle durch das bakterizid wirkende Präparat [[Stalinon]] auftraten, das 10 % Triethylzinn enthielt.<ref name="Pathologie">{{Literatur | Autor = Wolfgang Remmele, Günter Klöppel, Hans Kreipe und Werner Paulus | Titel = Pathologie: Neuropathologie | Verlag = Springer | ISBN = 978-3- |
Die Dämpfe von Tetraethylzinn können mit Luft ein explosionsfähiges Gemisch ([[Flammpunkt]] 53 °C) bilden.<ref name="GESTIS" /> Im Körper wandelt es sich zu dem toxischeren [[Triethylzinn]] um.<ref name=cremer>Jill E. Cremer (1958), "The biochemistry of organotin compounds. The conversion of tetraethyltin into triethyltin in mammals". In: ''[[Biochem J.]]'' volume 68, issue 4, S. 685–692, {{PMC|1200418}}.</ref> Diese Verbindung wurde 1953/54 als neurotoxische Substanz bekannt, als in Frankreich 110 Todesfälle durch das bakterizid wirkende Präparat [[Stalinon]] auftraten, das 10 % Triethylzinn enthielt.<ref name="Pathologie">{{Literatur | Autor = Wolfgang Remmele, Günter Klöppel, Hans Kreipe und Werner Paulus | Titel = Pathologie: Neuropathologie | Verlag = Springer | ISBN = 978-3-642-02323-1 | Jahr = 2011 | Online = {{Google Buch | BuchID = inXTym_SRk0C | Seite = 373 }} | Seiten = 373}}</ref> Triethylzinn hemmt die oxidative [[Phosphorylierung]], die [[Glucose]]-Oxidation sowie den Einbau von Phosphaten in [[Phospholipide]] und ist immunotoxisch.<ref name="buch">{{Literatur | Autor = Burkhard Madea | Titel = Praxis Rechtsmedizin: Befunderhebung, Rekonstruktion, Begutachtung | Verlag = | ISBN = 978-3-540-33719-5 | Jahr = 2006 | Online = {{Google Buch | BuchID = AIBLqYrYy2EC | Seite = 402 }} | Seiten = 402}}</ref> |
||
| ⚫ | |||
| ⚫ | |||
== Einzelnachweise == |
== Einzelnachweise == |
||
| Zeile 65: | Zeile 62: | ||
<ref name="Molbase">{{Internetquelle|url=http://www.molbase.com/en/hnmr_597-64-8-moldata-1462518.html#tabs |titel=tetraethylstannane 597-64-8 H-NMR – C-NMR Spectral Analysis |autor= |werk=molbase.com | sprache=en |datum= |zugriff=2015-05-03}}</ref> |
<ref name="Molbase">{{Internetquelle|url=http://www.molbase.com/en/hnmr_597-64-8-moldata-1462518.html#tabs |titel=tetraethylstannane 597-64-8 H-NMR – C-NMR Spectral Analysis |autor= |werk=molbase.com | sprache=en |datum= |zugriff=2015-05-03}}</ref> |
||
</references> |
</references> |
||
| ⚫ | |||
| ⚫ | |||
[[Kategorie:Zinnorganische Verbindung]] |
[[Kategorie:Zinnorganische Verbindung]] |
||
Version vom 16. Juni 2016, 08:27 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Tetraethylzinn | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C8H20Sn | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 234,96 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
1,187 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
181 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||
| Brechungsindex |
1,473 (20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
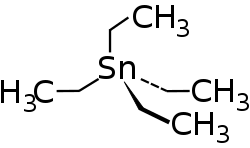
Tetraethylzinn ist eine chemische Verbindung aus der Gruppe der Zinnorganischen Verbindungen und hat die Konstitutionsformel Sn(C2H5)4.
Gewinnung und Darstellung
Tetraethylzinn kann durch Reaktion von Ethylmagnesiumbromid mit Zinn(IV)-chlorid gewonnen werden.[3]
Eigenschaften
Tetraethylzinn ist eine entzündliche farblose Flüssigkeit, die praktisch unlöslich in Wasser ist.[1] Im Kernresonanzspektrum zeigt es folgende Signale:[4]
| chemische Verschiebung (ppm) |
Sn–CH2– | –CH3 |
|---|---|---|
| 1H | 1,67 | 0,9 |
| 13C | 6,7 | 10,9 |
Verwendung
Tetraethylzinn wird als Reaktionsgas im CVD-Verfahren zur Herstellung funktioneller Schichten und leitfähiger transparenter Schichten verwendet. Es wurde auch als Pestizid, Fungizid und Bakterizid verwendet.[5]
Es wurde in den 1920er Jahren kurzfristig für den Einsatz als Antiklopfmittel für Ottokraftstoffe untersucht, jedoch schnell durch das effektivere Tetraethylblei ersetzt.[6]
Sicherheitshinweise
Die Dämpfe von Tetraethylzinn können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 53 °C) bilden.[1] Im Körper wandelt es sich zu dem toxischeren Triethylzinn um.[7] Diese Verbindung wurde 1953/54 als neurotoxische Substanz bekannt, als in Frankreich 110 Todesfälle durch das bakterizid wirkende Präparat Stalinon auftraten, das 10 % Triethylzinn enthielt.[8] Triethylzinn hemmt die oxidative Phosphorylierung, die Glucose-Oxidation sowie den Einbau von Phosphaten in Phospholipide und ist immunotoxisch.[9]
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Tetraethylzinn in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b Datenblatt Tetraethyltin, 97 % bei Sigma-Aldrich (PDF).
- ↑ G. J. M. Van Der Kerk and J. G. A. Luijten: Tetraethyltin In: Organic Syntheses. 36, 1956, S. 86, doi:10.15227/orgsyn.036.0086; Coll. Vol. 4, 1963, S. 881 (PDF).
- ↑ tetraethylstannane 597-64-8 H-NMR – C-NMR Spectral Analysis. In: molbase.com. Abgerufen am 3. Mai 2015 (englisch).
- ↑ Werner Baumann, Bettina Herberg-Liedtke: Chemikalien in der Metallbearbeitung. Springer, 1995, ISBN 978-3-540-60094-7, S. 1467 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Vaclav Smil Distinguished Professor University of Manitoba: Transforming the Twentieth Century : Technical Innovations and Their Consequences. Oxford University Press, 2006, ISBN 0-19-803775-9, S. 171 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jill E. Cremer (1958), "The biochemistry of organotin compounds. The conversion of tetraethyltin into triethyltin in mammals". In: Biochem J. volume 68, issue 4, S. 685–692, PMC 1200418 (freier Volltext).
- ↑ Wolfgang Remmele, Günter Klöppel, Hans Kreipe und Werner Paulus: Pathologie: Neuropathologie. Springer, 2011, ISBN 978-3-642-02323-1, S. 373 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Burkhard Madea: Praxis Rechtsmedizin: Befunderhebung, Rekonstruktion, Begutachtung. 2006, ISBN 978-3-540-33719-5, S. 402 (eingeschränkte Vorschau in der Google-Buchsuche).



