„Binodale“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Referenz eingefügt |
Artikel erweitert sowie Abbildungen, Einzelnachweise und Links ergänzt. Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 1: | Zeile 1: | ||
[[Bild:p-v-T-Diagramm.jpg|mini|250px|Druck-Volumen-Temperatur-Diagramm eines Reinstoffes. Die Koexistenzkurve umschließt das blau kolorierte Koexistenzgebiet der flüssigen Phase und der Gasphase.]] |
|||
[[Datei:Spinodale und Binodale.svg|mini|Binodalen (äußere Kurven)<br />im binären [[Flüssig-Flüssig-Extraktion|LLE]]]] |
|||
Als '''Binodale''' |
Als '''Binodale''' oder '''Koexistenzkurve''' wird diejenige Kurve in der [[P-v-T-Diagramm|Zustandsfläche]] eines Reinstoffes oder [[Gemisch|Gemisches]] bezeichnet, die ein Koexistenzgebiet, in dem koexistierende [[Phase|Phasen]] existieren, von der Menge der [[Zustand (Thermodynamik)|Zustände]] abgrenzt, in denen eine homogene Phase stabil ist.<ref>J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: ''Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994).'' In: ''Pure and Applied Chemistry''. Band 66, Nr. 3, 1994, S. 577–594, [[doi:10.1351/pac199466030577]].</ref> Wird im Verlauf einer [[Zustandsänderung]] die Binodale überquert, findet ein [[Phasenübergang]] statt, der zur Bildung koexistierender Phasen aus einer homogenen Phase oder zur Bildung einer homogenen Phase aus koexistierenden Phasen führt. |
||
=Thermodynamische Einordnung= |
|||
Wichtig ist dieses Konzept zum Beispiel bei [[Chemische Verbindung#Binäre, ternäre und quaternäre Verbindungen|binären]] [[Gemisch|Mischungen]]. Befindet man sich in einem geeigneten Temperaturbereich, kann durch allmähliche Erhöhung der [[Konzentration (Chemie)|Konzentration]] des einen Stoffes (Bewegung auf einer Linie parallel zur Zusammensetzungs-Achse, d. h. auf einer [[Konode]]) ein Punkt erreicht werden, an dem sich die beiden Stoffe nicht mehr [[homogen]] vermischen, sondern sich in zwei Phasen trennen, die nebeneinander koexistieren ([[Mischungslücke]]). |
|||
[[Datei:Phasendiagramm-Beispiel.svg|mini|250px|Projektion des Druck-Volumen-Temperatur-Diagramms eines Reinstoffes in die Druck-Temperatur-Ebene (die y-Achse ist die Druckachse). Die das Koexistenzgebiet von flüssiger Phase und Gasphase umschließende Koexistenzkurve erscheint als Verbindungslinie zwischen Tripelpunkt und kritischem Punkt.]] |
|||
Zustände, die koexistierende Phasen repräsentieren, müssen sich zumindest in einer [[Zustandsgröße]] unterscheiden. Wird die [[freie Enthalpie]] des betrachteten [[System|Systems]] als Funktion einer Zustandsgröße aufgetragen, in der sich die koexistierenden Phasen unterscheiden, weist die erhaltene Kurve zwei [[Extremwert|Minima]] auf. Wird die freie Enthalpie als Funktion der die Zustände der koexistierenden Phasen unterscheidenden Zustandsgröße für verschiedene Werte einer weiteren Zustandsgröße, in der sich die koexistierenden Phasen nicht unterscheiden, ermittelt, bilden die Minima der so erhaltenen Profile der freien Enthalpie in der Zustandsfläche des betrachteten Systems die Binodale. Die Positionen der Minima der freien Enthalpie definieren damit die Zustände der koexistierenden Phasen. Diese liegen entsprechend auf der Binodalen und werden durch eine [[Konode]] verbunden. |
|||
Die Extremwerte einer Binodalen werden als [[Kritischer Punkt (Thermodynamik)|kritische Punkte]] bezeichnet, wobei kritische Punkte sowohl in Form von Maxima als auch von Minima vorliegen können. Nähert man das System aus dem Koexistenzgebiet heraus einem kritischen Punkt an, rücken die Minima der freien Enthalpie als Funktion der die koexistierenden Phasen unterscheidenden Zustandsgröße zusammen, so dass sich die Eigenschaften der koexistierenden Phasen annähern. Am kritischen Punkt werden die Eigenschaften der koexistierenden Phasen innerhalb des Koexistenzgebiets sowie der außerhalb existierenden homogenen Phase ununterscheidbar.<ref name="Strobl">{{Literatur |Autor=Gert R. Strobl |Titel=The physics of polymers: concepts for understanding their structures and behavior |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3. Auflage |Verlag=Springer |Ort=Berlin/Heidelberg/New York |Datum=2007 |ISBN=978-3-540-68411-4 |DOI=10.1007/978-3-540-68411-4 |Seiten=S. 105 ff |Online=https://www.worldcat.org/oclc/191466701 |Abruf=2021-01-26}}</ref> Die Binodale umschließt weiterhin die innherhalb des Koexistenzgebietes verlaufende [[Spinodale]], mit der sie lediglich die kritischen Punkte gemeinsam hat.<ref name="Günter Jakob Lauth, Jürgen Kowalczyk">{{Literatur |Autor=Günter Jakob Lauth, Jürgen Kowalczyk |Titel=Thermodynamik: Eine Einführung |Verlag=Springer-Verlag |Ort= |Datum=2015 |Seiten=250 |ISBN=978-3-662-46229-4 |Online=[https://books.google.de/books?id=2LjpCQAAQBAJ&pg=PA250&dq=Binodale&hl=de&sa=X&ved=0ahUKEwjhxcuuhoPVAhVIEVAKHTdJBaEQ6AEILzAC#v=onepage&q=Binodale&f=false books.google.de]}}</ref> Innerhalb des Koexistenzgebietes ist eine homogene Phase im Bereich zwischen Binodaler und Spinodaler [[Metastabilität|metastabil]]. Die Umwandlung der metastabilen homogenen Phase in die stabilen koexistierenden Phasen verläuft dort über einen [[Keimbildung|Nukleationsmechanismus]]<ref>D. I. Bower: ''An Introduction to Polymer Physics''. Cambridge University Press, Cambridge 2002 ISBN 0-511-07757-2 (e-Book), ISBN 0-521-63137-8 (Hardcover), ISBN 0-521-63721-X (Paperback).</ref><ref>{{Literatur |Autor=Andrew Keller, Stephen Z.D. Cheng |Titel=The role of metastability in polymer phase transitions |Sammelwerk=Polymer |Band=39 |Nummer=19 |Datum=1998-09 |DOI=10.1016/S0032-3861(97)10320-2 |Seiten=4461–4487 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0032386197103202 |Abruf=2021-01-23}}</ref> und kann hinsichtlich ihres zeitlichen Verlaufs durch die [[Johnson-Mehl-Avrami-Kolmogorow-Gleichung]] beschrieben werden. |
|||
Für Zustände innerhalb der ''Spinodale'' sind Zweiphasenzustände die [[Thermodynamisches Gleichgewicht|Gleichgewichtszustände]] (Minimum der [[Gibbs-Energie|freien Enthalpie]] <math>G</math>), außerdem sind sie thermodynamisch stabil (die zweite [[Differentialrechnung|Ableitung]] der freien Enthalpie z. B. nach der Konzentration ist positiv). Für die Zustände zwischen Spinodale und Binodale ist der Zweiphasenzustand thermodynamisch ebenfalls am günstigsten (Minimum der freien Enthalpie), allerdings ist der Zustand ohne Entmischung nur [[metastabil]] (stabil gegen kleine Auslenkungen), da die zweite Ableitung der freien Enthalpie positiv ist.<ref name="Hermann Weingärtner">{{Literatur |Autor=Hermann Weingärtner |Titel=Chemische Thermodynamik: Einführung für Chemiker und Chemieingenieure |Verlag=Springer-Verlag |Ort= |Datum=2013 |Seiten=130 |ISBN=978-3-322-91221-3 |Online=[https://books.google.de/books?id=ACf2BQAAQBAJ&pg=PA130&dq=Binodale+Ableitung&hl=de&sa=X&ved=0ahUKEwjkkdGrh4PVAhUKKVAKHdOrBYAQ6AEILjAC#v=onepage&q=Binodale%20Ableitung&f=false books.google.de]}}</ref> |
|||
=Beispiele= |
|||
==Fluide Reinstoffe== |
|||
In den in Druck-Volumen-Temperatur-Diagrammen dargestellten Zustandsflächen fluider Reinstoffe treten Koexistenzgebiete von [[Flüssigkeit|flüssiger Phase]] und [[Gas|Gasphase]] auf, die von einer hier meist als Koexistenzkurve bezeichneten Binodalen umschlossen werden. Beim Übertritt von der flüssigen Phase in das Koexistenzgebiet [[Verdampfen|verdampft]] die Flüssigkeit. Beim Übertritt aus der Gasphase in das Koexistenzgebiet [[Kondensation|kondensiert]] das Gas. |
|||
In in die Druck-Volumen-Ebene projizierten Phasendiagrammen weist die Koexistenzkurve ein Maximum am kritischen Punkt auf und läuft mit zunehmendem Volumen [[Asymptote|asymptotisch]] gegen die Volumenachse. In in die Druck-Temperatur-Ebene projizierten Phasendiagrammen erscheint die Koexistenzkurve als Linie, die den [[Tripelpunkt]] mit dem kritischen Punkt verbindet und die als [[Siedepunkt#Siedepunktskurve|Siedepunktskurve]] bezeichnet wird. Der Grund hierfür ist, dass koexistierenden Phasen jeweils im thermischen Gleichgewicht stehen und daher dieselbe Temperatur und denselben Druck besitzen müssen. Die Konoden verlaufen somit parallel zur Volumenachse und stehen senkrecht auf der Druck-Temperatur-Ebene. In der Druck-Temperatur-Ebene fallen die Äste der Koexistenzkurve beiderseits des kritischen Punktes folgedessen zusammen.<ref>{{Literatur |Autor=Klaus Stierstadt |Titel=Thermodynamik |Verlag=Springer-Verlag |Ort=Berlin/Heidelberg |Datum=2010 |Reihe=Springer-Lehrbuch |ISBN=978-3-642-05097-8 |DOI=10.1007/978-3-642-05098-5 |Online=http://link.springer.com/10.1007/978-3-642-05098-5|Abruf=2021-01-27}} Siehe Kapitel 9, Abbildung 9.5.</ref> |
|||
==Gemische== |
|||
[[Datei:Spinodale und Binodale.svg|mini|250px|Temperatur-Zusammensetzungs-Phasendiagramm eines Gemisches.]] |
|||
[[Gemisch|Gemische]] können eine [[Mischungslücke]] aufweisen, die von einer Binodale umgrenzt ist. Außerhalb der Mischungslücke liegt das Gemisch als homogene [[Mischphase]] vor, während es innerhalb der Mischungslücke koexistierende Phasen bildet. Die kritischen Punkte der Binodalen weisen dabei entweder obere oder untere [[Kritische Lösungstemperatur|kritische Lösungstemperaturen]] auf. Binodalen von Gemischen werden häufig in [[Temperatur]]-Zusammensetzungs-[[Phasendiagramm]] oder in [[Dreiecksdiagramm|Dreiecksdiagrammen]]<ref>Burkhard Lohrengel: ''Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen''. 3. Auflage. Walter de Gruyter, Berlin 2017, ISBN 9783110473520. Siehe Kapitel "6.6.2 Bilanzlinie im Dreiecksdiagramm".</ref> projiziert, wobei letztere die Zusammensetzung [[Ternäres Gemisch|ternärer Gemische]] darstellen. Die Schnittpunkte der Konoden mit den Binodalen definieren dabei jeweils die Zusammensetzungen der koexistierenden Phasen.<ref name="Strobl" /> |
|||
=Literatur= |
|||
* {{Literatur |Autor=Pablo G.Debenedetti|Titel=Metastable liquids: concepts and principles |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage= |Verlag=Princeton University Press |Ort=Princeton, N.J. |Datum=1996 |ISBN=0-691-08595-1 |Seiten= |Online=https://www.worldcat.org/oclc/34604232 |Abruf=2021-01-27}} |
|||
*{{Literatur |Autor=Peter Stephan, Karlheinz Schaber, Karl Stephan, Franz Mayinger |Titel=Thermodynamik – Grundlagen und technische Anwendungen |Band=2: Mehrstoffsysteme und chemische Reaktionen|Verlag=Springer-Verlag | Ort=Berlin ||Datum=2017 |DOI=10.1007/978-3-662-54439-6 |Online=https://link.springer.com/book/10.1007%2F978-3-662-54439-6 |Abruf=2021-01-27}} |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 27. Januar 2021, 17:51 Uhr
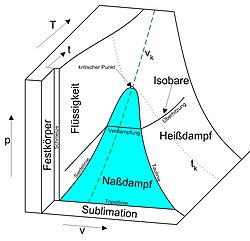
Als Binodale oder Koexistenzkurve wird diejenige Kurve in der Zustandsfläche eines Reinstoffes oder Gemisches bezeichnet, die ein Koexistenzgebiet, in dem koexistierende Phasen existieren, von der Menge der Zustände abgrenzt, in denen eine homogene Phase stabil ist.[1] Wird im Verlauf einer Zustandsänderung die Binodale überquert, findet ein Phasenübergang statt, der zur Bildung koexistierender Phasen aus einer homogenen Phase oder zur Bildung einer homogenen Phase aus koexistierenden Phasen führt.
Thermodynamische Einordnung

Zustände, die koexistierende Phasen repräsentieren, müssen sich zumindest in einer Zustandsgröße unterscheiden. Wird die freie Enthalpie des betrachteten Systems als Funktion einer Zustandsgröße aufgetragen, in der sich die koexistierenden Phasen unterscheiden, weist die erhaltene Kurve zwei Minima auf. Wird die freie Enthalpie als Funktion der die Zustände der koexistierenden Phasen unterscheidenden Zustandsgröße für verschiedene Werte einer weiteren Zustandsgröße, in der sich die koexistierenden Phasen nicht unterscheiden, ermittelt, bilden die Minima der so erhaltenen Profile der freien Enthalpie in der Zustandsfläche des betrachteten Systems die Binodale. Die Positionen der Minima der freien Enthalpie definieren damit die Zustände der koexistierenden Phasen. Diese liegen entsprechend auf der Binodalen und werden durch eine Konode verbunden.
Die Extremwerte einer Binodalen werden als kritische Punkte bezeichnet, wobei kritische Punkte sowohl in Form von Maxima als auch von Minima vorliegen können. Nähert man das System aus dem Koexistenzgebiet heraus einem kritischen Punkt an, rücken die Minima der freien Enthalpie als Funktion der die koexistierenden Phasen unterscheidenden Zustandsgröße zusammen, so dass sich die Eigenschaften der koexistierenden Phasen annähern. Am kritischen Punkt werden die Eigenschaften der koexistierenden Phasen innerhalb des Koexistenzgebiets sowie der außerhalb existierenden homogenen Phase ununterscheidbar.[2] Die Binodale umschließt weiterhin die innherhalb des Koexistenzgebietes verlaufende Spinodale, mit der sie lediglich die kritischen Punkte gemeinsam hat.[3] Innerhalb des Koexistenzgebietes ist eine homogene Phase im Bereich zwischen Binodaler und Spinodaler metastabil. Die Umwandlung der metastabilen homogenen Phase in die stabilen koexistierenden Phasen verläuft dort über einen Nukleationsmechanismus[4][5] und kann hinsichtlich ihres zeitlichen Verlaufs durch die Johnson-Mehl-Avrami-Kolmogorow-Gleichung beschrieben werden.
Beispiele
Fluide Reinstoffe
In den in Druck-Volumen-Temperatur-Diagrammen dargestellten Zustandsflächen fluider Reinstoffe treten Koexistenzgebiete von flüssiger Phase und Gasphase auf, die von einer hier meist als Koexistenzkurve bezeichneten Binodalen umschlossen werden. Beim Übertritt von der flüssigen Phase in das Koexistenzgebiet verdampft die Flüssigkeit. Beim Übertritt aus der Gasphase in das Koexistenzgebiet kondensiert das Gas.
In in die Druck-Volumen-Ebene projizierten Phasendiagrammen weist die Koexistenzkurve ein Maximum am kritischen Punkt auf und läuft mit zunehmendem Volumen asymptotisch gegen die Volumenachse. In in die Druck-Temperatur-Ebene projizierten Phasendiagrammen erscheint die Koexistenzkurve als Linie, die den Tripelpunkt mit dem kritischen Punkt verbindet und die als Siedepunktskurve bezeichnet wird. Der Grund hierfür ist, dass koexistierenden Phasen jeweils im thermischen Gleichgewicht stehen und daher dieselbe Temperatur und denselben Druck besitzen müssen. Die Konoden verlaufen somit parallel zur Volumenachse und stehen senkrecht auf der Druck-Temperatur-Ebene. In der Druck-Temperatur-Ebene fallen die Äste der Koexistenzkurve beiderseits des kritischen Punktes folgedessen zusammen.[6]
Gemische

Gemische können eine Mischungslücke aufweisen, die von einer Binodale umgrenzt ist. Außerhalb der Mischungslücke liegt das Gemisch als homogene Mischphase vor, während es innerhalb der Mischungslücke koexistierende Phasen bildet. Die kritischen Punkte der Binodalen weisen dabei entweder obere oder untere kritische Lösungstemperaturen auf. Binodalen von Gemischen werden häufig in Temperatur-Zusammensetzungs-Phasendiagramm oder in Dreiecksdiagrammen[7] projiziert, wobei letztere die Zusammensetzung ternärer Gemische darstellen. Die Schnittpunkte der Konoden mit den Binodalen definieren dabei jeweils die Zusammensetzungen der koexistierenden Phasen.[2]
Literatur
- Pablo G.Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1 (worldcat.org [abgerufen am 27. Januar 2021]).
- Peter Stephan, Karlheinz Schaber, Karl Stephan, Franz Mayinger: Thermodynamik – Grundlagen und technische Anwendungen. 2: Mehrstoffsysteme und chemische Reaktionen. Springer-Verlag, Berlin 2017, doi:10.1007/978-3-662-54439-6 (springer.com [abgerufen am 27. Januar 2021]).
Einzelnachweise
- ↑ J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1994, S. 577–594, doi:10.1351/pac199466030577.
- ↑ a b Gert R. Strobl: The physics of polymers: concepts for understanding their structures and behavior. 3. Auflage. Springer, Berlin/Heidelberg/New York 2007, ISBN 978-3-540-68411-4, S. 105 ff., doi:10.1007/978-3-540-68411-4 (worldcat.org [abgerufen am 26. Januar 2021]).
- ↑ Günter Jakob Lauth, Jürgen Kowalczyk: Thermodynamik: Eine Einführung. Springer-Verlag, 2015, ISBN 978-3-662-46229-4, S. 250 (books.google.de).
- ↑ D. I. Bower: An Introduction to Polymer Physics. Cambridge University Press, Cambridge 2002 ISBN 0-511-07757-2 (e-Book), ISBN 0-521-63137-8 (Hardcover), ISBN 0-521-63721-X (Paperback).
- ↑ Andrew Keller, Stephen Z.D. Cheng: The role of metastability in polymer phase transitions. In: Polymer. Band 39, Nr. 19, September 1998, S. 4461–4487, doi:10.1016/S0032-3861(97)10320-2 (elsevier.com [abgerufen am 23. Januar 2021]).
- ↑ Klaus Stierstadt: Thermodynamik (= Springer-Lehrbuch). Springer-Verlag, Berlin/Heidelberg 2010, ISBN 978-3-642-05097-8, doi:10.1007/978-3-642-05098-5 (springer.com [abgerufen am 27. Januar 2021]). Siehe Kapitel 9, Abbildung 9.5.
- ↑ Burkhard Lohrengel: Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen. 3. Auflage. Walter de Gruyter, Berlin 2017, ISBN 9783110473520. Siehe Kapitel "6.6.2 Bilanzlinie im Dreiecksdiagramm".