„Rubidiumoxalat“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Rr2000 (Diskussion | Beiträge) K WikiCleaner 0.99 - Weblink mit zwei eckigen Klammern (Detection by Wikipedia:WikiProject Check Wikipedia) |
Reaktionsgleichungen, Quelle |
||
| Zeile 28: | Zeile 28: | ||
: <math>\mathrm{ Rb_2CO_3 + (COOH)_2 \longrightarrow Rb_2(COO)_2 + H_2O + CO_2 \uparrow }</math> |
: <math>\mathrm{ Rb_2CO_3 + (COOH)_2 \longrightarrow Rb_2(COO)_2 + H_2O + CO_2 \uparrow }</math> |
||
Es entsteht auch bei der thermischen Zersetzung von [[Rubidiumformiat]].<ref name="Meisel"/> |
|||
:<math>\mathrm{2\ HCOORb \ \xrightarrow { \ \Delta \ } \ \ (COO)_2Rb_2 + H_2 \uparrow}</math> |
|||
== Eigenschaften == |
== Eigenschaften == |
||
Rubidiumoxalat kristallisiert als Monohydrat (COO)<sub>2</sub>Rb<sub>2</sub> im [[monoklines Kristallsystem|monoklinen]] Kristallsystem.<ref name="Lax">Jean D'Ans, Ellen Lax: ''Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3.'' 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 686f. ({{Google Buch|BuchID=oWjEKDnsJgEC|Seite=686}})</ref> und ist isomorph zum [[Kaliumoxalat]]<nowiki/>-Monohydrat.<ref name="Pedersen>Björn Pedersen: "The Equilibrium Hydrogen-Hydrogen Distances in the Water Molecules in Potassium and Rubidium Oxalate Monohydrates" in ''Acta Cryst.'' '''1966''', ''20'', S. 412ff. {{doi|10.1107/S0365110X66000951}}</ref> Vom Anhydrat existieren bei Raumtemperatur zwei Modifikationen: Eine Modifikation ist monoklin und isotyp zu [[Caesiumoxalat]], die andere ist [[orthorhombisches Kristallsystem|orthorhombisch]] und isotyp zum Kaliumoxalat.<ref name="Dinnebier">R. E. Dinnebier, S. Vensky, M. Panthöfer, M. Jansen: "Crystal and molecular structures of alkali oxalates: first proof of a staggered oxalate anion in the solid state." in ''Inorg. Chem'' '''2003''', ''42''(5), S. 1499-1507. [http://www.ncbi.nlm.nih.gov/pubmed/12611516 Abstract]</ref> Frisch hergestelltes wasserfreies Rubidiumoxalat enthält zunächst hauptsächlich die monokline Phase, diese wandelt sich jedoch langsam irreversibel in die orthorhombische Modifikation um.<ref name="Vensky">Dissertation: "Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs", Sascha Vensky, Universität Stuttgart, 2004. S. 117ff.[http://elib.uni-stuttgart.de/opus/volltexte/2004/1912/pdf/Dissertation-S_Vensky.pdf PDF]</ref> |
Rubidiumoxalat [[Kristallisation|kristallisiert]] als Monohydrat (COO)<sub>2</sub>Rb<sub>2</sub> im [[monoklines Kristallsystem|monoklinen]] Kristallsystem.<ref name="Lax">Jean D'Ans, Ellen Lax: ''Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3.'' 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 686f. ({{Google Buch|BuchID=oWjEKDnsJgEC|Seite=686}})</ref> und ist isomorph zum [[Kaliumoxalat]]<nowiki/>-Monohydrat.<ref name="Pedersen>Björn Pedersen: "The Equilibrium Hydrogen-Hydrogen Distances in the Water Molecules in Potassium and Rubidium Oxalate Monohydrates" in ''Acta Cryst.'' '''1966''', ''20'', S. 412ff. {{doi|10.1107/S0365110X66000951}}</ref> Vom Anhydrat existieren bei Raumtemperatur zwei [[Polytypie|Modifikationen]]: Eine Modifikation ist monoklin und [[isotyp]] zu [[Caesiumoxalat]], die andere ist [[orthorhombisches Kristallsystem|orthorhombisch]] und isotyp zum Kaliumoxalat.<ref name="Dinnebier">R. E. Dinnebier, S. Vensky, M. Panthöfer, M. Jansen: "Crystal and molecular structures of alkali oxalates: first proof of a staggered oxalate anion in the solid state." in ''Inorg. Chem'' '''2003''', ''42''(5), S. 1499-1507. [http://www.ncbi.nlm.nih.gov/pubmed/12611516 Abstract]</ref> Frisch hergestelltes wasserfreies Rubidiumoxalat enthält zunächst hauptsächlich die monokline [[Phase (Thermodynamik)|Phase]], diese wandelt sich jedoch langsam irreversibel in die orthorhombische Modifikation um.<ref name="Vensky">Dissertation: "Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs", Sascha Vensky, Universität Stuttgart, 2004. S. 117ff.[http://elib.uni-stuttgart.de/opus/volltexte/2004/1912/pdf/Dissertation-S_Vensky.pdf PDF]</ref> |
||
'''Kristalldaten der verschiedenen Modifikationen von Rubidiumoxalat:''' |
'''Kristalldaten der verschiedenen Modifikationen von Rubidiumoxalat:''' |
||
| Zeile 44: | Zeile 48: | ||
|} |
|} |
||
Die Standardbildungsenthalpie des kristallinen Rubidiumoxalates beträgt 1325,0 ± 8,1 kJ/mol.<ref name="Masuda">Y. Masuda, H. Miyamoto, Y. Kaneko, K. Hirosawa: "The standard molar enthalpies of formation of crystalline rubidium and cesium oxalates" in ''J. Chem. Thermodynamics'' '''1985''', ''17''(2), S. 159-164. {{doi|10.1016/0021-9614(85)90068-0}}</ref> |
Die [[Standardbildungsenthalpie]] des kristallinen Rubidiumoxalates beträgt 1325,0 ± 8,1 kJ/mol.<ref name="Masuda">Y. Masuda, H. Miyamoto, Y. Kaneko, K. Hirosawa: "The standard molar enthalpies of formation of crystalline rubidium and cesium oxalates" in ''J. Chem. Thermodynamics'' '''1985''', ''17''(2), S. 159-164. {{doi|10.1016/0021-9614(85)90068-0}}</ref> |
||
| ⚫ | Die Zersetzung von Rubidiumoxalat unter Freisetzung von [[Kohlenmonoxid]] sowie in weiterer Folge [[Kohlendioxid]] und [[Sauerstoff]] findet bei 507 - 527 °C statt.<ref name="Vensky"/><ref name="Meisel">T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in ''Journal of Thermal Analysis and Calorimetry'' '''1975''', ''7''(1). S. 73-80. {{doi|10.1007/BF01911627}}</ref> |
||
:<math>\mathrm{(COO)_2Rb_2 \ \xrightarrow { \ \Delta \ } \ \ Rb_2CO_3 + CO \uparrow}</math> |
|||
:<math>\mathrm{Rb_2CO_3 \ \xrightarrow { \ \Delta \ } \ \ Rb_2O + CO_2 \uparrow}</math> |
|||
:<math>\mathrm{2\ Rb_2O \ \xrightarrow { \ \Delta \ } \ \ 4\ Rb + O_2 \uparrow}</math> |
|||
| ⚫ | |||
Neben dem neutralen Rubidiumoxalat existiert auch ein saures Tetraoxalat mit der Formel RbH<sub>3</sub>(COO)<sub>2</sub>, das als Dihydrat kristallisiert, bei 18 °C eine Dichte von 2,125 g/cm<sup>-3</sup> und bei 21 °C eine Löslichkeit von 21 g/l besitzt.<ref name="Abegg">R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435.[http://www.archive.org/stream/handbuchderanor09koppgoog#page/n455/mode/2up Volltext]</ref> |
Neben dem neutralen Rubidiumoxalat existiert auch ein saures Tetraoxalat mit der Formel RbH<sub>3</sub>(COO)<sub>2</sub>, das als Dihydrat kristallisiert, bei 18 °C eine Dichte von 2,125 g/cm<sup>-3</sup> und bei 21 °C eine Löslichkeit von 21 g/l besitzt.<ref name="Abegg">R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435.[http://www.archive.org/stream/handbuchderanor09koppgoog#page/n455/mode/2up Volltext]</ref> |
||
Version vom 19. November 2010, 12:07 Uhr
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 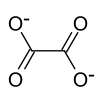
| |||||||
| Allgemeines | |||||||
| Name | Rubidiumoxalat | ||||||
| Summenformel | Rb2C2O4 | ||||||
| Kurzbeschreibung |
farblose, glanzlose Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,76 g·cm−3[1](Monohydrat) | ||||||
| Schmelzpunkt |
Zersetzung[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Rubidiumoxalat ist das Rubidiumsalz der Oxalsäure.
Herstellung
Rubidiumoxalat kann aus Rubidiumcarbonat und Oxalsäure hergestellt werden.[3]
Es entsteht auch bei der thermischen Zersetzung von Rubidiumformiat.[4]
Eigenschaften
Rubidiumoxalat kristallisiert als Monohydrat (COO)2Rb2 im monoklinen Kristallsystem.[1] und ist isomorph zum Kaliumoxalat-Monohydrat.[5] Vom Anhydrat existieren bei Raumtemperatur zwei Modifikationen: Eine Modifikation ist monoklin und isotyp zu Caesiumoxalat, die andere ist orthorhombisch und isotyp zum Kaliumoxalat.[6] Frisch hergestelltes wasserfreies Rubidiumoxalat enthält zunächst hauptsächlich die monokline Phase, diese wandelt sich jedoch langsam irreversibel in die orthorhombische Modifikation um.[2]
Kristalldaten der verschiedenen Modifikationen von Rubidiumoxalat:
| Modifikation | Kristallsystem | Raumgruppe | a [Å] | b [Å] | c [Å] | β | Z |
|---|---|---|---|---|---|---|---|
| Alpha[6] | monoklin | P21/c | 6,328 | 10,455 | 8,217 | 98,016° | 4 |
| Beta[6] | orthorhombisch | Pbam | 11,288 | 6,295 | 3,622 | - | 2 |
| Monohydrat[7] | monoklin | C2/c | 9,617 | 6,353 | 11,010 | 109,46° | 4 |
Die Standardbildungsenthalpie des kristallinen Rubidiumoxalates beträgt 1325,0 ± 8,1 kJ/mol.[8]
Die Zersetzung von Rubidiumoxalat unter Freisetzung von Kohlenmonoxid sowie in weiterer Folge Kohlendioxid und Sauerstoff findet bei 507 - 527 °C statt.[2][4]
Neben dem neutralen Rubidiumoxalat existiert auch ein saures Tetraoxalat mit der Formel RbH3(COO)2, das als Dihydrat kristallisiert, bei 18 °C eine Dichte von 2,125 g/cm-3 und bei 21 °C eine Löslichkeit von 21 g/l besitzt.[9]
Einzelnachweise
- ↑ a b c Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 686f. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c Dissertation: "Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs", Sascha Vensky, Universität Stuttgart, 2004. S. 117ff.PDF
- ↑ E. Giglio, S. Loreti, N. V. Pavel: "EXAFS: A New Approach to the Structure of Micellar Aggregates" in J. Phys. Chem. 1988, 92, S. 2858-2862. doi:10.1021/j100321a032
- ↑ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in Journal of Thermal Analysis and Calorimetry 1975, 7(1). S. 73-80. doi:10.1007/BF01911627
- ↑ Björn Pedersen: "The Equilibrium Hydrogen-Hydrogen Distances in the Water Molecules in Potassium and Rubidium Oxalate Monohydrates" in Acta Cryst. 1966, 20, S. 412ff. doi:10.1107/S0365110X66000951
- ↑ a b c R. E. Dinnebier, S. Vensky, M. Panthöfer, M. Jansen: "Crystal and molecular structures of alkali oxalates: first proof of a staggered oxalate anion in the solid state." in Inorg. Chem 2003, 42(5), S. 1499-1507. Abstract
- ↑ Takuya Echigo, Mitsuyoshi Kimata: "The common role of water molecule and lone electron pair as a bond-valence mediator in oxalate complexes : the crystal structures of Rb2(C2O4) · H2O and Tl2(C2O4)" in Zeitschrift für Kristallographie 2006, 221(12), S. 762-769. Abstract
- ↑ Y. Masuda, H. Miyamoto, Y. Kaneko, K. Hirosawa: "The standard molar enthalpies of formation of crystalline rubidium and cesium oxalates" in J. Chem. Thermodynamics 1985, 17(2), S. 159-164. doi:10.1016/0021-9614(85)90068-0
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435.Volltext




