Aluminiumsulfid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
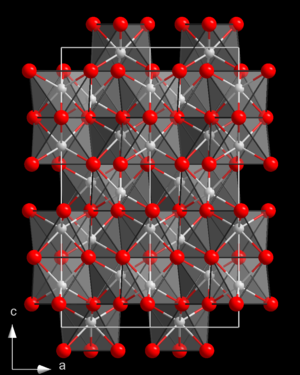
| ||||||||||
| __ Al3+ __ S2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Aluminiumsulfid | |||||||||
| Verhältnisformel | Al2S3 | |||||||||
| Kurzbeschreibung |
Gelbliches Pulver oder kleine Kriställchen[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 150,158 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,02 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1500 °C (sublimiert) [4] | |||||||||
| Löslichkeit |
heftige Reaktion mit Wasser unter Freisetzung von Schwefelwasserstoff[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−724,0 kJ/mol[6] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||

Aluminiumsulfid ist eine chemische Verbindung aus der Gruppe der Sulfide mit der Formel Al2S3.
Herstellung
Aluminiumsulfid kann einfach aus den Elementen hergestellt werden:[1]
Die Reaktion ist extrem exotherm und kann Temperaturen über 1100 °C erreichen, so dass das Produkt geschmolzen vorliegt. Bei der Wahl des Reaktionsgefäßes ist dies zu beachten. Das abgekühlte Produkt liegt in kleinen Kristallen vor und ist sehr hart.
Auch durch Reaktion von Aluminium mit Schwefelwasserstoff kann es erzeugt werden.[1]
Eigenschaften
Aluminiumsulfid ist ein gelbliches kristallines Pulver, das durch überschüssiges elementares Aluminium grau gefärbt sein kann. Es ist trimorph, kommt also in drei unterschiedlichen Kristallstrukturen vor. Dies sind eine Struktur vom Aluminiumoxid-Typ (Raumgruppe R3c (Raumgruppen-Nr. 161); Gitterparameter a = 647, c = 1227 pm), ein hexagonaler Typ (a = 642,3, c = 1783 pm) und ein Wurtzit-ähnlicher Typ (Raumgruppe P63/mcm (Nr. 193); a = 620,0, c = 582,9 pm).[1]
Die Verbindung ist gegenüber Feuchtigkeit empfindlich, der Kontakt mit Wasser führt zur Hydrolyse und der Bildung von Schwefelwasserstoff und Aluminiumhydroxid.[1] Diese Reaktion kann schon durch die Luftfeuchtigkeit ausgelöst werden. Unter oxidierenden Bedingungen kann sich der Stoff auch unter Freisetzung von Schwefeldioxid-Gas zersetzen.[7]
Einzelnachweise
- ↑ a b c d e Georg Brauer: Handbuch der Präparativen Anorganischen Chemie Band II, Ferdinand Enke Verlag, Stuttgart 1978, ISBN 3-432-87813-3, S. 833.
- ↑ a b Datenblatt Aluminum sulfide bei Sigma-Aldrich (PDF).
- ↑ a b Brockhaus ABC Chemie, F.A. Brockhausverlag Leipzig 1971, S. 59.
- ↑ Sicherheitsdatenblatt bei ESPI Metals, abgerufen am 5. Januar 2012.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-5.
- ↑ A. F. Holleman, E. Wiberg: Inorganic Chemistry. Academic Press, San Diego 2001, ISBN 0-12-352651-5.

