Ammoniumoxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumoxalat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | (NH4)2C2O4 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses, kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 124,1 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,48 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
Zersetzung: etwa 70 °C[1] | |||||||||||||||
| Löslichkeit |
löslich in Wasser (45 g·l−1 bei 20 °C) [1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1123,0 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
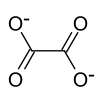
Ammoniumoxalat, Formel (NH4)2C2O4[3], ist eine kristalline chemische Verbindung aus der Gruppe der Oxalate, also der Salze der Oxalsäure.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Ammoniumoxalat kann durch Neutralisation von Oxalsäure mit Ammoniaklösung hergestellt werden.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ammoniumoxalat bildet rhombische Kristalle, ist farblos und in Wasser löslich. Beim Erhitzen zersetzt sich die Verbindung zu Ammoniak, Wasser, Kohlendioxid und Kohlenmonoxid.[4]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ammoniumoxalat wird als Nachweismittel für Calcium-Ionen verwendet, wobei schwer lösliches Calciumoxalat entsteht, das als weißer Niederschlag ausfällt. Durch Reaktion mit Bariumchlorid kann Bariumoxalat gewonnen werden.[5]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Ammoniumoxalat kommt in der Natur als das sehr seltene Mineral Oxammit vor. Es bildet sich in Guanolagerstätten als Produkt der Ausscheidungen von Seevögeln oder Fledermäusen.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Patent US4018875A: Ammonium oxalate process. Angemeldet am 4. März 1975, veröffentlicht am 19. April 1977, Erfinder: Robert Kenneth Jordan.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Diammoniumoxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-47.
- ↑ Eintrag zu Ammoniumoxalat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Juli 2019.
- ↑ Wilhelm Hurka: Chemisches Praktikum für Mediziner. Springer-Verlag, 2013, ISBN 978-3-662-02242-9, S. 32 (eingeschränkte Vorschau in der Google-Buchsuche).



