Ammoniumoxalat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Ammoniumoxalat | |||||||||
| Andere Namen |
| |||||||||
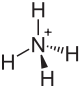
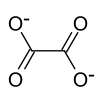
| Summenformel | (NH4)2C2O4 | |||||||||
| Kurzbeschreibung |
farb- und geruchloses, kristallines Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 124,1 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,48 g·cm−3[1] | |||||||||
| Schmelzpunkt |
Zersetzung: etwa 70 °C[1] | |||||||||
| Löslichkeit |
löslich in Wasser: 45 g·l−1 (20 °C) [1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−1123,0 kJ/mol[2] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Ammoniumoxalat, Formel (NH4)2C2O4[3], ist eine kristalline chemische Verbindung aus der Gruppe der Oxalate, also der Salze der Oxalsäure.
Gewinnung und Darstellung
Ammoniumoxalat kann durch Neutralisation von Oxalsäure mit Ammoniaklösung hergestellt werden.
Eigenschaften
Ammoniumoxalat bildet rhombische Kristalle, ist farblos und in Wasser löslich.
Verwendung
Ammoniumoxalat wird als Nachweismittel für Calcium-Ionen verwendet, wobei schwer lösliches Calciumoxalat entsteht, das als weißer Niederschlag ausfällt.
Vorkommen
Ammoniumoxalat kommt in der Natur als das sehr seltene Mineral Oxammit vor. Es bildet sich in Guanolagerstätten als Produkt der Ausscheidungen von Seevögeln oder Fledermäusen.
Weblinks
- Freepatentsonline: Ammonium oxalate process
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Diammoniumoxalat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-47.

