Asinger-Reaktion

Die Asinger-Reaktion oder auch Asinger-Thiazolin-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde durch Friedrich Asinger während seines Zwangsaufenthaltes in der Sowjetunion – im Rahmen der Deportation deutscher Wissenschaftler (Aktion Ossawakim) – entdeckt.[1] Die Asinger-Reaktion zählt zu den Mehrkomponentenreaktionen und wird auch als A-4CR (Abkürzung für Asinger-Vierkomponentenreaktion) klassifiziert: Aus elementarem Schwefel, einem α-substituierbaren Keton oder Aldehyd, einer weiteren Carbonylkomponente und Ammoniak entstehen in guter Ausbeute 3-Thiazoline[2] oder Gemische mehrerer 3-Thiazoline.


Alternativen[Bearbeiten | Quelltext bearbeiten]
Alternativ können 3-Thiazoline auch aus α-Mercaptoaldehyden oder α-Mercaptoketonen, einer Oxokomponente (Aldehyd oder Keton) und Ammoniak entstehen.[3] Damit die Reaktion ablaufen kann, muss an das α-Kohlenstoffatom (Kohlenstoffatom neben dem Carbonyl-Kohlenstoffatom) mindestens ein Wasserstoffatom gebunden sein (sowohl bei der Reaktion mit einem Aldehyd als auch bei der mit einem Keton).
Mechanismus[Bearbeiten | Quelltext bearbeiten]
Beispielhaft wird der Mechanismus mit einem Aldehyd (R3 = H) dargestellt, alternativ kann die Reaktion auch mit einem Keton (R3 = Organylgruppe, z. B. Alkylgruppe) stattfinden. Diese verläuft analog.
Erster Schritt: Durch eine Thiolierungsreaktion bildet sich intermediär ein α-Mercaptoaldehyd (R3 = H) oder ein α-Mercaptoketon (R3 = Organylgruppe). Bei der α-Thiolierung wird basenkatalysiert – hier im Speziellen aminkatalysiert (durch den Einsatz von Ammoniak) – das H-Atom in α-Stellung ersetzt. Die Reaktion wird durch ein Aldehyd eingeleitet.
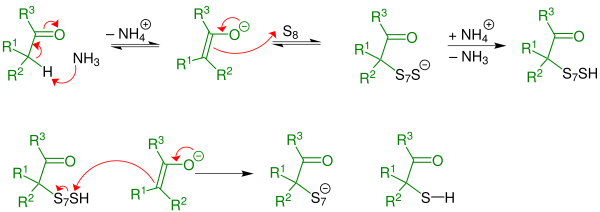
Zweiter Schritt: Der α-Mercaptoaldehyd reagiert irreversibel mit einem zweiten Aldehyd-Molekül und Ammoniak zum 3-Thiazolin. Das zweite Aldehyd-Molekül tritt hier als „Oxokomponente“ in die Ringschlussreaktion ein. Es handelt sich um eine α-Amino-alkylierung einer SH-aciden Verbindung mit folgender cyclischer Stabilisierung durch Wasserabspaltung.

Varianten[Bearbeiten | Quelltext bearbeiten]
Eine universellere Variante der Asinger-Reaktion wurde bei der Degussa AG entwickelt. Dabei reagiert eine α-halogenierte Carbonyl-Komponente mit Natriumhydrogensulfid und generiert in situ eine α-Mercapto-Carbonyl-Komponente (Thiol), welche direkt mit Aldehyden oder Ketonen und Ammoniak zu 3-Thiazolinen weiterreagieren:[4]

In der chemischen Industrie wurden, basierend auf der Asinger-Reaktion, mehrstufige Verfahren zur Herstellung des Arzneistoffes D-Penicillamin[5] (Penicillamin: R = Methylgruppe) und von DL-Cystein (R = H)[6] entwickelt und im technischen Maßstab betrieben.

Die Synthese von 3-Oxazolinen (Sauerstoff-Analoga der 3-Thiazoline) erfolgt nach einer Variante der Asinger-Reaktion aus 2-Halogenaldehyden, Ammoniak, Natronlauge und einer Oxokomponente (meist ein Keton).[7]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 68, Nr. 12, 1956, S. 413–413, doi:10.1002/ange.19560681209.
- ↑ Organikum. 23. Aufl. Wiley-VCH, 2009, ISBN 978-3-527-32292-3, S. 434.
- ↑ Friedrich Asinger, Manfred Thiel: Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme. In: Angewandte Chemie. 70, Nr. 22–23, 1958, S. 667–683, doi:10.1002/ange.19580702202.
- ↑ Karlheinz Drauz, Hans Günter Koban, Jürgen Martens, Werner Schwarze: Phosphonic and Phosphinic Acid Analogs of Penicillamine. In: Liebigs Annalen der Chemie. 1985, Nr. 3, 1985, S. 448–452, doi:10.1002/jlac.198519850303.
- ↑ Wolfgang M. Weigert, Heribert Offermanns, Paul Scherberich: D-Penicillamin – Herstellung und Eigenschaften. In: Angewandte Chemie. 87, Nr. 10, 1975, S. 372–378, doi:10.1002/ange.19750871003. Englische Version in: Angewandte Chemie-International Edition. 14, 1975, S. 330–336.
- ↑ Jürgen Martens, Heribert Offermanns, Paul Scherberich: Einfache Synthese von racemischem Cystein. In: Angewandte Chemie. 93, Nr. 8, 1981, S. 680–683, doi:10.1002/ange.19810930808. Englische Version in: Angewandte Chemie-International Edition. 20, 1981, S. 668.
- ↑ Maya Weber, Jürgen Jakob und Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen. In: Liebigs Annalen der Chemie. 1992, Nr. 1, 1992, S. 1–6, doi:10.1002/jlac.199219920102.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Friedrich Asinger: Chemiker-Treffen Salzburg: Über die einfache und ergiebige Synthese von Thiazolinen. In: Angewandte Chemie. 68, 1956, S. 376–389, doi:10.1002/ange.19560681109.
- Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 68, 1956, S. 413–413, doi:10.1002/ange.19560681209.
- Imre Schlemminger, Hans-Hermann Janknecht, Wolfgang Maison, Wolfgang Saak, Jürgen Martens: Synthesis of the first enantiomerically pure 3-thiazolines via Asinger reaction. In: Tetrahedron Letters 41, 2000, S. 7289–7292, doi:10.1016/S0040-4039(00)01266-1.
- Jürgen Martens, Hans-Herrmann Janknecht: Synthese von 2-tert-Butyl-3-thiazolinen und Untersuchungen zur Diastereoselektivität der Asinger-Reaktion. In: Sulfur Letters. 11, 1990, S. 263–270.