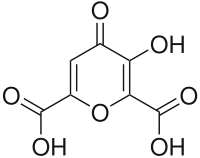
Mekonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mekonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H4O7 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Nadeln, Blättchen oder Schuppen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 200,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Mekonsäure, auch Acidum Meconicum genannt, ist eine chemische Verbindung aus der Gruppe der Pyrone, die in einigen Mohngewächsen (Papaveraceae), etwa in Schlafmohn (Papaver somniferum) und Arznei-Mohn (Papaver bracteatum), enthalten ist. Die Verbindung ist mit 4–6 % einer der Inhaltsstoffe des Opiums (mekón = griech. Mohnkapsel)[6] und kann dadurch zum Nachweis von Opium benutzt werden.


Mekonsäure wurde irrtümlich als narkotisch wirksam beschrieben, obwohl es keine oder nur eine geringe pharmakologische Wirkung zeigt und auch nicht medizinisch verwendet wird. Das Pyron bildet mit Alkaloiden und Metallen Salze, die Mekonate. Der französische Chemiker Armand Seguin war mit seinen Experimenten bis 1804 so weit gediehen, Mekonsäure erzeugen zu können, ohne jedoch zu wissen, ob es sich dabei um eine bestimmte Säure oder um eine mit pflanzlichen Bestandteilen verunreinigte Mischung handelte.[7] Erstmals isoliert wurde Mekonsäure schließlich 1805 von Friedrich Sertürner.[8][9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Mekonsäure zählt zu den Dicarbonsäuren; sie ist mit dem pKs1-Wert 1,83 und pKs2 von 2,11 eine starke Säure.[3] Ihre Struktur enthält neben zwei Carboxygruppen (–COOH) eine Hydroxygruppe (–OH), die an einem Pyronring lokalisiert sind. Diese OH-Gruppe ist schwach sauer mit einem pKs-Wert von 11,3.[6] Die Substanz ist farblos und nur wenig in Wasser und Methanol, besser in Ethanol und Benzol löslich.[10][3] Auskristallisieren aus wässriger Lösung führt zu einem Trihydrat,[3] das orthorhombische Plättchen bildet.[2] Beim Erhitzen zersetzt sich Mekonsäure schrittweise, wobei sich bei Temperaturen ab 200 °C durch einfache Decarboxylierung Komensäure bildet.[11] Mekonsäure zeigt – wie auch einige Phenole und Phenolsäuren – eine rote Färbung bei der Reaktion mit Eisen(III)-chlorid und wird zum titrimetrischen Nachweis von Fe(III)-Ionen eingesetzt.[3]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Scott Lovell, Paramjeet Subramony and Bart Kahr: Poppy Acid: Synthesis and Crystal Chemistry; in: J. Am. Chem. Soc.; 1999, 121 (30); S. 7020–7025; doi:10.1021/ja990402a.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Friedrich Philipp Dulk: Die preußische Pharmakopöe: Einfache Mittel. Voß; 1833, S. 761 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-296.
- ↑ a b c d e f g Alan Townshend: Dictionary of analytical reagents. Chapman & Hall / CRC Press, 1993, ISBN 0-412-35150-1, S. 595.
- ↑ Eintrag zu Meconic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Eintrag zu Mekonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Mai 2019.
- ↑ James R. Partington: A History of Chemistry, Band 3, Macmillan, London u. a. 1962 (Nachdruck 1970), S. 107.
- ↑ Friedrich Sertuerner: Ueber das Morphium, eine neue salzfähige Grundlage, und die Mekonsäure, als Hauptbestandtheile des Opiums. Annalen der Physik, 1817, 55, S. 56–89.
- ↑ Ryan J. Huxtable, Stephan K. W. Schwarz: The Isolation of Morphine — First Principles in Science and Ethics.
- ↑ Acidum Meconicum (Henriette's Herbal Homepage)
- ↑ A. M. Pictet: Die Pflanzenalkalode und ihre chemische Konstitution. BiblioBazaar, 2009, ISBN 978-1-110-11341-5 (eingeschränkte Vorschau in der Google-Buchsuche).