Xanthoprotein-Reaktion

Die Xanthoprotein-Reaktion (griech.: xanthos „gelb“, proteuo „ich nehme den ersten Platz ein“) ist eine Nachweisreaktion für aromatische Aminosäuren in Proteinen.[1] Zu den aromatischen Aminosäuren gehören solche, die einen Benzolring enthalten (Phenylalanin, Tyrosin und Tryptophan).
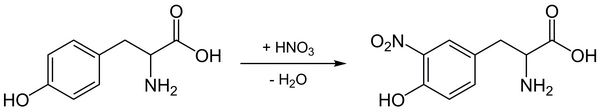
Bei der Zugabe von Salpetersäure (HNO3) findet eine Nitrierung am Benzolring statt.
Gibt man die Salpetersäure zum Eiklar, findet eine Ausflockung statt, die auf die Denaturierung des Eiklars durch die Säure zurückzuführen ist. Erhitzt man diese Lösung zusätzlich, entsteht eine gelbe Nitroverbindung. Dabei wird ein Wasserstoffatom durch die NO2-Gruppe (aus der Salpetersäure) substituiert. So verfärbt sich die Haut beim Kontakt mit konzentrierter Salpetersäure gelblich, da die Hautzellen Proteine mit aromatischen Aminosäuren enthalten.
Weitere Nachweisreaktionen für Eiweiße
Einzelnachweise
- ↑ Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998 ISBN 3-7776-0808-4.