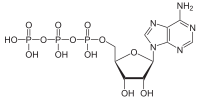
Adenosinphosphosulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Adenosinphosphosulfat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H14N5O10PS | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 507,27 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Adenosinphosphosulfat, genauer Adenosin-5’-phosphosulfat, abgekürzt APS, ist ein energiereiches Säureanhydrid von Schwefelsäure und der Phosphatgruppe von Adenosinmonophosphat im Stoffwechsel von Pflanzen und Mikroorganismen.
Biochemie
[Bearbeiten | Quelltext bearbeiten]Adenosinphosphosulfat ist ein Zwischenprodukt bei der Reduktion von Sulfat zu Sulfit, das den ersten Schritt der assimilatorischen Sulfatreduktion – weiterführend zur Sulfidstufe des Schwefels – oder die Erzeugung von Sulfatestern darstellt.[2] Da eine Direktreduktion freien Sulfates zu Sulfit energetisch ungünstig wäre (E0'=−0,5162 V), wird die Reduktion durch Verbrauch von ATP gekoppelt. Diese Reduktion katalysiert eine Sulfat-Adenylyltransferase (EC 2.7.7.4), bei der das entstehende Pyrophosphat noch hydrolysiert wird:
Die in APS vorkommende Sulfatgruppe kann dann entweder weiter durch eine APS-Reduktase (EC 1.8.99.2) zu Sulfit reduziert, oder durch Phosphorylierung an der 3’-OH-Gruppe der Ribose zu PAPS (Phospho-APS oder 3’-Phosphoadenosin-5’-phosphosulfat) „aktiviert“ werden (PAPS ist umgangssprachlich auch als „aktiviertes Sulfat“ bekannt).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Adenosine 5′-phosphosulfate sodium salt bei Sigma-Aldrich, abgerufen am 18. Februar 2012 (PDF).
- ↑ Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. Thieme, Stuttgart; Auflage: 15. überarb. u. neugestalt. Auflage 2005; ISBN 978-3133578158; S. 445.