Asinger-Reaktion
Die Asinger-Reaktion oder auch Asinger-Thiazolin-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde durch Friedrich Asinger während seines Zwangsaufenthaltes in der Sowjetunion – im Rahmen der Deportation deutscher Wissenschaftler (Aktion Ossoawiachim) – entdeckt[1]. Die Asinger-Reaktion zählt zu den Mehrkomponentenreaktionen und wird auch als A-4CR (Abkürzung für Asinger-Vierkomponentenreaktion) klassifiziert: Aus elementarem Schwefel, einem α-substituierbarem Keton oder Aldehyd, einer weiteren Carbonylkomponente und Ammoniak, entstehen in guter Ausbeute 3-Thiazoline[2] oder Gemische mehrerer 3-Thiazoline.


Alternativen
Alternativ können 3-Thiazoline auch aus α-Mercaptoaldehyden oder α-Mercaptoketonen, einer Oxokomponente (Aldehyd oder Keton) und Ammoniak entstehen.[3]. Damit die Reaktion ablaufen kann muss an das α-Kohlenstoffatom (Kohlenstoffatom neben dem Carbonyl-Kohlenstoffatom) mindestens ein Wasserstoffatom gebunden sein (sowohl bei der Reaktion mit einem Aldehyd als auch bei der mit einem Keton)
Mechanismus
Beispielhaft wird der Mechanismus mit einem Aldehyd dargestellt, alternativ kann die Reaktion auch mit einem Keton stattfinden. Diese verläuft analog.
Erster Schritt : Durch eine Thiolierungsreaktion bildet sich intermediär ein α-Mercaptoketon. Bei der α-Thiolierung wird basenkatalysiert - hier im Speziellen aminkatalysiert (durch den Einsatz von Ammoniak)- das H-Atom in α-Stellung ersetzt. Die Reaktion wird durch ein Aldehyd eingeleitet.
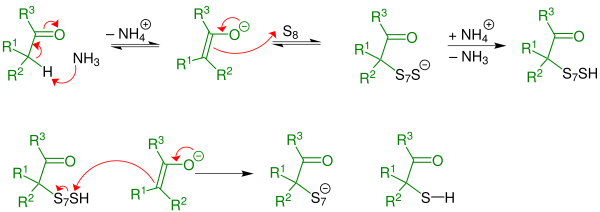
Zweiter Schritt: Das α-Mercaptoketon reagiert irreversibel mit Aldehyd und Ammoniak zum 3-Thiazolin. Das Aldehyd tritt hier als Oxokomponente in die Ringschlussreaktion ein. Es handelt sich um eine α-Amino-alkylierung einer SH-aciden Verbindung mit folgender cyclischer Stabilisierung durch Wasseraustritt.

Varianten
Eine universellere Variante der Asinger-Reaktion wurde bei der Degussa AG entwickelt. Dabei reagiert eine α-halogenierte Carbonyl-Komponente mit NaHS und generiert in situ eine α-Mercapto-Carbonyl-Komponente (Thiol), welche direkt mit Aldehyden oder Ketonen und Ammoniak zu 3-Thiazolinen weiterreagieren[4]:
In der chemischen Industrie wurden, basierend auf der Asinger-Reaktion, mehrstufige Verfahren zur Herstellung des Arzneistoffes D-Penicillamin[5] (Penicillamin: R = Methylgruppe) und von DL-Cystein (R = H)[6] entwickelt und im technischen Maßstab betrieben.
Die Synthese von 3-Oxazolinen (Sauerstoff-Analoga der 3-Thiazoline) erfolgt nach einer Variante der Asinger-Reaktion aus 2-Halogenaldehyden, Ammoniak, Natronlauge und einer Oxokomponente (meist ein Keton).[7]
Literatur
- Friedrich Asinger: Chemiker-Treffen Salzburg: Über die einfache und ergiebige Synthese von Thiazolinen. In: Angewandte Chemie. 68, 1956, S. 376–389, doi:10.1002/ange.19560681109.
- Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 68, 1956, S. 413–413, doi:10.1002/ange.19560681209.
- Imre Schlemminger, Hans-Hermann Janknecht, Wolfgang Maison, Wolfgang Saak, Juergen Martens: Synthesis of the first enantiomerically pure 3-thiazolines via Asinger reaction. In: Tetrahedron Letters 41, 2000, S. 7289–7292,doi:10.1016/S0040-4039(00)01266-1.
- Jürgen Martens und Hans-Herrmann Janknecht: Synthese von 2-tert-Butyl-3-thiazolinen und Untersuchungen zur Diastereoselektivität der Asinger-Reaktion. In: Sulfur Letters. 11, 1990, S. 263–270.
Einzelnachweise
- ↑ Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone, Angewandte Chemie 68 (1956) 413.
- ↑ Organikum, Wiley-VCH Verlag GmbH, 23. Auflage, 2009, S. 434, ISBN 978-3-527-32292-3.
- ↑ Friedrich Asinger und Manfred Thiel: Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme, Angewandte Chemie 70 (1958) 667–683.
- ↑ Karlheinz Drauz, Hans Günter Koban, Jürgen Martens und Werner Schwarze: Phosphonic and Phosphinic Acid Analogs of Penicillamine, Liebigs Annalen der Chemie 1985, 448-452.
- ↑ Wolfgang Weigert, Heribert Offermanns und Paul Scherberich : D-Penicillamin - Herstellung und Eigenschaften, Angewandte Chemie 87 (1975) 372-378 ; Angewandte Chemie-International Edition 14 (1975) 330-336.
- ↑ Jürgen Martens, Heribert Offermanns und Paul Scherberich : Eine einfache Synthese von racemischem Cystein, Angewandte Chemie 93 (1981) 680; Angewandte Chemie-International Edition 20 (1981) 668.
- ↑ Maya Weber, Jürgen Jakob und Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen, Liebigs Annalen der Chemie 1992, 1-6.

