Benutzer:Whoopie23/Aldoladdition
Die Aldoladdition ist eine Additionsreaktion aus dem Bereich der organischen Chemie. Bei der Aldoladdition reagieren Aldehyde und Ketone zu Aldolen, das sind β-Hydroxyaldehyde oder β-Hydroxyketone.
Aldole sind chemische Verbindungen, die in ihrem Grundgerüst sowohl eine Aldehyd-, als auch eine Alkoholfunktion haben.
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Die Aldoladdition wird hier beispielhaft an der Reaktion von zwei Molekülen des Acetaldehyds durchgeführt. Die Reaktion verläuft entweder basen- oder säurekatalysiert:
Die grüne Bindung im Aldol ist die neu geknüpfte Verbindung zwischen den beiden Aldehyden.
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Die base- und säurekatalysierten Mechanismen der Aldoladdition werden an der Beispielreaktion von zwei Molekülen Acetaldehyd erklärt.
Basenkatalysierte Aldoladdition
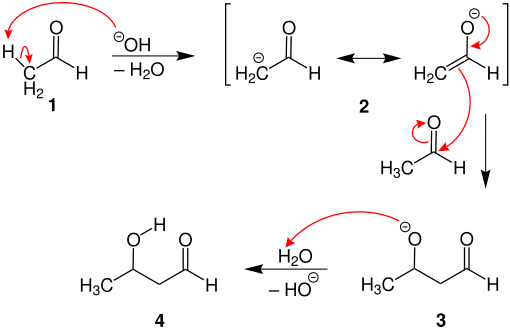
[Bearbeiten | Quelltext bearbeiten]Im Folgenden wird der Mechnismus der basenkatalysierten Aldoladdition anhand des obigen Beispiels vorgestellt:
Das zur Carbonylgruppe des Acetaldehys α-ständige Wasserstoffatom ist aufgrund der Carbonylverbindung acide, d.h. dass an der α-Position des Kohlestoffatoms ein Wasserstoffatom durch eine starke Base abgespalten werden kann. In diesem Beispiel wird der Acetaldehyd (1) durch ein Hydroxid-Ion deprotoniert. Es entsteht ein mesomeriestabilisiertes Carbanion/Enolat 2. Das nucleophile Enolat 2 greift die Carbonylgruppe eines weiteren Acetaldehyds an. Es bildet sich ein Alkoholat 3, das durch ein Proton protoniert wird. Damit bildet sich ein Aldol 4, in diesem Fall 3-Hydroxybutanal.[1]
Säurekatalysierte Aldoladdition
[Bearbeiten | Quelltext bearbeiten]Im Folgenden wird der Mechnismus der säurekatalysierten Aldoladdition ebenfals am obigen Beispiels vorgestellt:
Bei der säurekatalysierten Aldoladdition wird das Sauerstoffatom der Carbonylgruppe des Acetaldehyds (1) protoniert. In Gegenwart einer Säure bildet sicha aus dem Acetaldehyd im Zuge einer Keto-Enol-Tautomerie ein Enol. Dieses greift nun die protonierte Carbonylgruppe 5 nucleophil an. Es bildet sich ein protoniertes Aldol 6. Durch Deprotonierung entsteht ebenfalls 3-Hydroxybutanal (4).[1]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
- J. Buddrus, B. Schmidt: Grundlagen der organischen Chemie. 4. überarbeitete und aktualisierte Auflage, Walter de Gruyter, Berlin/New York 2011, ISBN 978-3-11-024894-4.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b J. Buddrus, B. Schmidt: Grundlagen der organischen Chemie. 4. überarbeitete und aktualisierte Auflage, Walter de Gruyter, Berlin/New York 2011, ISBN 978-3-11-024894-4, S. 616 ff. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Buddrus_616 ff“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert.
[[Kategorie:Chemische Reaktion]]