Dinatriumhexachloroiridat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
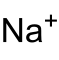 
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dinatriumhexachloroiridat | |||||||||||||||
| Andere Namen |
Natriumhexachloroiridat(IV) | |||||||||||||||
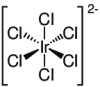
| Summenformel | Na2[IrCl6] | |||||||||||||||
| Kurzbeschreibung |
rotschwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 558,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (344 g/l, Hexahydrat)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Dinatriumhexachloroiridat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Hexachloroiridate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dinatriumhexachloroiridat kann durch Reaktion von Iridium mit Natriumchlorid im Chlorstrom bei 625 °C gewonnen werden. Man lässt es im Chlorstrom langsam abkühlen, damit etwa gebildetes nach
wieder oxidiert wird.[3]
Es bildet sich auch aus Iridium(IV)-oxid in Natriumchloridschmelzen in Gegenwart von Chlor.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dinatriumhexachloroiridat ist ein rot-schwarzer Feststoff, der als Hydrat löslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Dinatriumhexachloroiridat-Hexahydrat wird für pharmazeutische und organische Zwischenprodukte und zur Herstellung anderer Iridium(IV)-komplexe verwendet.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 379 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d Eintrag zu Sodium hexachloroiridate(IV) hexahydrate, Ir 33.9% min bei Thermo Fisher Scientific, abgerufen am 8. Februar 2024.
- ↑ Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1736.
- ↑ Hermann Sicius: Cobaltgruppe: Elemente der neunten Nebengruppe - Eine Reise durch das Periodensystem. Springer-Verlag, 2016, ISBN 978-3-658-16346-4, S. 30 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 877 (eingeschränkte Vorschau in der Google-Buchsuche).

![{\displaystyle {\ce {Na3[IrCl6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15ddad0bc6bc6dfb20ee4cad7bb4869baedd7755)
![{\displaystyle {\ce {2 Na3[IrCl6] + Cl2 -> 2 Na2[IrCl6] + 2 NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/871a1e31f94323e439e619700160ffea3fb54836)