GMP-Reduktase
Zur Navigation springen
Zur Suche springen
| GMP-Reduktase | ||
|---|---|---|

| ||
| Masse/Länge Primärstruktur | 345/348 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Name(n) | GMPR, GMPR2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.7.1.7, Oxidoreduktase | |
| Reaktionsart | red. Desaminierung | |
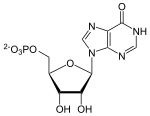
| Substrat | GMP + NADPH/H+ | |
| Produkte | IMP + NH3 + NADP+ | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten, Bakterien | |
GMP-Reduktasen (GMPR) sind Enzyme in Eukaryoten und Bakterien, die die Desaminierung von GMP zu IMP katalysieren. Diese Reaktionen dienen der Rückgewinnung und Aufrechterhaltung der Balance von Purinnukleotiden in der Zelle.[1]
Menschen haben zwei Gene, die für GMPR codieren (GMPR und GMPR2 auf den Chromosomen 6 und 114)[2], die jeweils zwei Spleißvarianten erzeugen. GMPR2 hat möglicherweise eine weitere Funktion bei der Differenzierung von Monozyten.[3]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]Von GMP wird Ammoniak abgespalten und IMP entsteht. Die Reaktion ist irreversibel.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt P36959, UniProt Q9P2T1
- ↑ GMPR und GMPR2
- ↑ J. Zhang, W. Zhang, D. Zou, G. Chen, T. Wan, M. Zhang, X. Cao: Cloning and functional characterization of GMPR2, a novel human guanosine monophosphate reductase, which promotes the monocytic differentiation of HL-60 leukemia cells. In: Journal of Cancer Research and Clinical Oncology. Band 129, Nummer 2, Februar 2003, S. 76–83, ISSN 0171-5216. doi:10.1007/s00432-002-0413-7. PMID 12669231.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Biochemie und Pathobiochemie: Purin-Stoffwechsel – Lern- und Lehrmaterialien