Silberpermanganat
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Ag+ _ Mn7+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silberpermanganat | ||||||||||||||||||
| Andere Namen |
Silbermanganat(VII) | ||||||||||||||||||
| Verhältnisformel | AgMnO4 | ||||||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 226,8 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
4,49 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (Silberpermanganat 9 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Silberpermanganat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Permanganate.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Silberpermanganat kann durch Reaktion einer Silbernitratlösung mit Kaliumpermanganat bei 80 °C gewonnen werden.[1]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
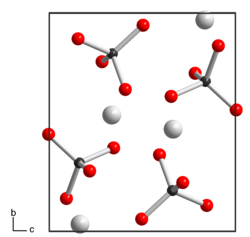
Silberpermanganat ist ein lichtempfindlicher violetter[2] bis schwarzer Feststoff mit metallisch glänzenden, nadelförmigen Kristallen, der in Wasser schwer löslich ist. Zersetzung beginnt beim Erwärmen auf über 160 °C oder bei längerer Aufbewahrung. Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und den Gitterparametern a = 567 pm, b = 827 pm, c = 713 pm, β = 92,5°.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Silberpermanganat wird in Gasmasken und als Antiseptikum verwendet.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1586.
- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 369 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
