Verhältnisformel


Eine Verhältnisformel (nach IUPAC Empirische Formel,[1][2] nach der nicht mehr gültigen DIN-Norm 32641 Elementarformel, gelegentlich auch Substanzformel genannt) gibt die kleinstmöglichen Zahlenverhältnisse der Atome der beteiligten chemischen Elemente in einer chemischen Verbindung an. Die Verhältnisformel berücksichtigt nicht die chemische Struktur einer Verbindung und ist das Ergebnis einer quantitativen Elementaranalyse. Sie ist zweckmäßig für Salze, aber unterscheidet sich meist von der Molekül- oder Summenformel einer molekularen Verbindung, bei der die realen Zahlen der Atome im Molekül angegeben werden.
Historische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Noch bis ins 20. Jahrhundert hinein hatten Verhältnisformeln eine große Bedeutung, da sie experimentell oft einfacher oder zuverlässiger zu bestimmen waren als die Molekül- oder Summenformel. Die Verhältnisformel gab in vielen Fällen den experimentellen Befund wieder, während die Molekülformeln bisweilen auf zusätzlichen Annahmen beruhten. Aufgrund der sehr genauen modernen Strukturbestimmungsmethoden liegt gerade für große, aber wohldefinierte Proben der Fall bisweilen umgekehrt. Bei Proteinen beispielsweise ist es sinnvoll, aus der Struktur die Molekülformel zu bestimmen, aus der die Verhältnisformel exakt abgeleitet werden kann. Dies ist oft genauer als durch eine einfache Elementaranalyse.
Die Aussagekraft einer Molekülformel ist viel höher als die einer Verhältnisformel. Insbesondere kann aus der Molekülformel leicht die Verhältnisformel abgeleitet werden, während dies umgekehrt nur mit Hilfe zusätzlicher Angaben möglich ist. Verhältnisformeln haben daher nur noch eine relativ geringe praktische Bedeutung für Moleküle. Für ionische Verbindungen ist dagegen oft nur die Angabe der Verhältnisformel sinnvoll.
Übersicht
[Bearbeiten | Quelltext bearbeiten]| Strukturformeln | andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronen- formel |
Valenzstrich- formel |
Keilstrich- formel |
Skelett- formel |
Konstitutions- formel |
Summen- formel |
Verhältnis- formel | |
| Methan | 
|

|

|
existiert nicht |
CH4 | CH4 | CH4 |
| Propan | 
|

|

|
CH3–CH2–CH3 oder CH3 CH2 CH3 |
C3H8 | C3H8 | |
| Essigsäure | 
|

|
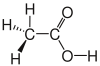
|

|
CH3–COOH oder CH3 COOH |
C2H4O2 | CH2O |
| Wasser | existiert nicht |
H–O–H oder H O H |
H2O | H2O | |||
Darstellung/Erklärung
[Bearbeiten | Quelltext bearbeiten]Die Atome eines Elementes werden in der Verhältnisformel durch die im Periodensystem (PSE) angegebenen Symbole bezeichnet. Das jeweilige Verhältnis wird durch tiefgestellte Zahlen (Indices) gekennzeichnet, wobei eine 1 stets weggelassen wird.
Beispiel: Die Verbindung Kupfer(I)-sulfid wird durch die Verhältnisformel Cu2S angegeben. Sie enthält Kupfer- und Schwefelionen im Verhältnis 2:1.
Die Verhältnisformel unterscheidet sich in manchen Fällen von der Summenformel (Molekülformel), die die tatsächlichen Atomzahlen angibt. So hätte die Verbindung Phosphorpentoxid mit der Molekülformel P4O10 die Verhältnisformel P2O5. Essigsäure hat die Verhältnisformel CH2O, jedoch die Summenformel C2H4O2. Für Wasser ist die Verhältnisformel H2O gleich der Summenformel.
Bestimmung
[Bearbeiten | Quelltext bearbeiten]Bei unbekannten chemischen Verbindungen werden die Verhältnisformeln mittels Elementaranalyse bestimmt. Die qualitative Elementaranalyse dient dabei der Ermittlung der vorhandenen Elemente (Nachweisreaktionen) und die quantitative Elementaranalyse der Bestimmung des Verhältnisses der Atomzahlen. Über die Bestimmung der molaren Masse lässt sich die Summenformel ermitteln.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu empirical formula. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E02063 – Version: 2.3.1.
- ↑ Wolfgang Liebscher: Nomenklatur der Anorganischen Chemie. John Wiley & Sons, 2009.