„Molybdän-Cofaktor“ – Versionsunterschied
| [ungesichtete Version] | [ungesichtete Version] |
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie |
|||
{{Chembox |
|||
| ⚫ | |||
| verifiedrevid = 444017528 |
|||
| Suchfunktion = C10H12MoN5O8PS2 |
|||
| ⚫ | |||
| Andere Namen = Moco |
|||
| ImageSize = 200px |
|||
| Summenformel = C<sub>10</sub>H<sub>12</sub>MoN<sub>5</sub>O<sub>8</sub>PS<sub>2</sub> |
|||
| IUPACName = |
|||
| CAS = [http://www.commonchemistry.org/ChemicalDetail.aspx?ref=872689-63-9 872689-63-9] |
|||
| OtherNames = Moco |
|||
| PubChem = [http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=25202532 872689-63-9] |
|||
| Section1 = {{Chembox Identifiers |
|||
| Beschreibung = |
|||
| CASNo_Ref = {{cascite|correct|??}} |
|||
| Molare Masse = 521.27 g·[[mol]]<sup>−1</sup> |
|||
| CASNo = 872689-63-9 |
|||
| Aggregat = |
|||
| PubChem = 25202532 |
|||
| Dichte = <!-- g·cm<sup>−3</sup> --> |
|||
| DrugBank_Ref = {{drugbankcite|correct|drugbank}} |
|||
| Schmelzpunkt = <!-- °C --> |
|||
| DrugBank = DB02137 |
|||
| Siedepunkt = <!-- °C --> |
|||
| SMILES = [S-]C1=C([S-])C(N2)C(OC1COP(O)(O)=O)NC3=C2C(N=C(N)N3)=O.O=[Mo+2]=O |
|||
| Sublimationspunkt = <!-- °C --> |
|||
| Dampfdruck = <!-- [[Pascal (Einheit)|Pa]] ( °C) --> |
|||
| Löslichkeit = <!-- ??? löslich in ???: g·l<sup>−1</sup> ( °C) --> |
|||
| Quelle GHS-Kz = |
|||
| GHS-Piktogramme = {{GHS-Piktogramme|/}} |
|||
| GHS-Signalwort = |
|||
| H = {{H-Sätze|/}} |
|||
| EUH = {{EUH-Sätze|/}} |
|||
| P = {{P-Sätze|/}} |
|||
| Quelle P = <!-- <ref name="Quellname" /> --> |
|||
| Quelle GefStKz = |
|||
| Gefahrensymbole = {{Gefahrensymbole|/}} |
|||
| R = {{R-Sätze|/}} |
|||
| S = {{S-Sätze|/}} |
|||
| MAK = <!-- ml·m<sup>−3</sup>, mg·m<sup>−3</sup> --> |
|||
| LD50 = <!-- mg·kg<sup>−1</sup> (Organismus, Applikationsart) --> |
|||
}} |
}} |
||
| ⚫ | '''Molybdän-Kofaktore''' sind [[Cofaktor_(Biochemie)|Kofaktoren]] die für die Aktivität von [[Enzym]]en wie [[Sulfitoxidase]]n, [[Xanthinoxidase]]n und [[Aldehydoxidase]]n verantwortlich sind.<ref name="pmid16261263>{{Literatur | Autor=G. Schwarz | Titel=Molybdenum cofactor biosynthesis and deficiency | Sammelwerk=Cell. Mol. Life Sci. | Band=62 | Nummer=23 | Jahr=2005 |Monat=Dezember | Seiten=2792–810 | DOI=10.1007/s00018-005-5269-y | PMID=16261263}} </ref><ref name="pmid18411266">{{Literatur | Autor = Smolinsky B, Eichler SA, Buchmeier S, Meier JC, Schwarz G | Titel = Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis | Sammelwerk = J. Biol. Chem. | Band = 283 | Nummer = 25 | Jahr=2008 | Monat=Jumi | Seiten = 17370–9 |pmid = 18411266 | doi = 10.1074/jbc.M800985200 }}</ref> Es handelt sich dabei um eine Koordinationsverbindung zwischen [[Molybdopterin]] und einem [[Molybdän]]-[[Oxid]]. |
||
| Section2 = {{Chembox Properties |
|||
| C=10 | H=12 | Mo=1 | N=5 | O=8 | P=1 | S=2 |
|||
| Appearance = |
|||
| Density = |
|||
| MeltingPt = |
|||
| BoilingPt = |
|||
| Solubility = }} |
|||
| Section3 = {{Chembox Hazards |
|||
| MainHazards = |
|||
| FlashPt = |
|||
| Autoignition = }} |
|||
}} |
|||
[[Image:MoPtSyn.png|thumb|300px|right|Some biosynthetic steps leading to molybdenum pterin, a molydopterin.]] |
|||
| ⚫ | ''' |
||
Molybdopterins, in turn, are synthesized from [[guanosine triphosphate]] (see synthetic route at right). |
|||
Molybdenum cofactor functions directly in [[ethylbenzene dehydrogenase]], [[glyceraldehyde-3-phosphate ferredoxin oxidoreductase]], and [[respiratory arsenate reductase]] |
|||
In animals and plants these enzymes use molybdenum bound at the active site in a tricyclic '''molybdenum cofactor'''. All molybdenum-using enzymes so far identified in nature use this cofactor, save for the phylogenetically ancient molybdenum [[nitrogenase]]s, which fix nitrogen in some bacteria and [[cyanobacteria]].<ref>[http://pathway.gramene.org/META/NEW-IMAGE?type=COMPOUND&object=CPD-4] Structure, synthesis, empirical formula for the di-sulfhydryl. Accessed Nov. 16, 2009.</ref> Molybdenum enzymes in plants and animals catalyze the oxidation and sometimes reduction of certain small molecules, as part of the regulation of [[Nitrogen cycle|nitrogen]], [[Sulfur cycle|sulfur]] and [[carbon cycle]]s.<ref>{{cite journal|title = A structural comparison of molybdenum cofactor-containing enzymes|journal=FEMS Microbiol. Rev.|year =1999|volume = 22|doi = 10.1111/j.1574-6976.1998.tb00384.x|pmid =9990727|issue = 5|pages = 503–521|last1 = Kisker|first1 = C.|last2 = Schindelin|first2 = H. |last3 = Baas|first3 = D.|last4 = Rétey|first4 = J.|last5 = Meckenstock| first5 = R.U|last6 = Kroneck| first6 = P.M.H}}</ref> |
|||
==See also== |
|||
*[[Molybdenum cofactor deficiency]], a genetic illness. |
|||
*[[MOCOS]], molybdenum cofactor sulfurase |
|||
*[[MOCS1]], [[MOCS2]], [[MOCS3]], [[GEPH]] |
|||
Die benötigten Molydopterine werden aus Guanosintriphosphat synthesiert (siehe Skizze an der Seite). |
|||
==References== |
|||
{{reflist}} |
|||
In Pflanzen und Tieren nutzen die Enzyme die trizyklische Seite der Molybdän-Kofaktoren. Alle modyben nutzenden, bisher entdeckten Enzyme nutzen diesen Konfaktor. |
|||
{{Enzyme cofactors}} |
|||
Molybdän-Kofaktore, bis auf die [[phylogenetisch]]en alternativen Molybdänen [[Nitrogenase]], die Stickstoff in einigen Bakterien und [[Cyanobakterien]] binden. |
|||
<ref name="molybdän"> [http://pathway.gramene.org/META/NEW-IMAGE?type=COMPOUND&object=CPD-4] Über Molybdän.</ref> |
|||
Molybdänische Enzyme in Pflanzen und Tieren Katalysieren die Oxidation und manchmal die Reduction von bestimmten kleinen Molekülen, als Teil der Stickstoffregulation, Schwefel und Kohlenstoffringen. <ref name="Katalysation"> {{Literatur|Autor= Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U; Kroneck, P.M.H|Titel = A structural comparison of molybdenum cofactor-containing enzymes|Sammelwerk=FEMS Microbiol. Rev.|Band = 22|Nummer = 5|Jahr =1999|Seiten = 503–521|DOI = 10.1111/j.1574-6976.1998.tb00384.x|PMID =9990727}}</ref> |
|||
[[Category:Cofactors]] |
|||
[[Category:Molybdenum heterocycles]] |
|||
[[Category:Organophosphates]] |
|||
[[Category:Nitrogen heterocycles]] |
|||
[[Category:Oxygen heterocycles]] |
|||
[[Category:Sulfur heterocycles]] |
|||
[[Datei:MoPtSyn.png|miniatur|Einige Biosynthetische Schritte bei der Bildung von Molydopterin.]] |
|||
==Einzelnachweise== |
|||
{{biochem-stub}} |
|||
<references/> |
|||
Version vom 26. Februar 2014, 22:12 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
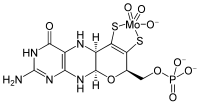
| ||||||||||
| Allgemeines | ||||||||||
| Name | Molybdän-Cofaktor | |||||||||
| Andere Namen |
Moco | |||||||||
| Summenformel | C10H12MoN5O8PS2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 521.27 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Molybdän-Kofaktore sind Kofaktoren die für die Aktivität von Enzymen wie Sulfitoxidasen, Xanthinoxidasen und Aldehydoxidasen verantwortlich sind.[1][2] Es handelt sich dabei um eine Koordinationsverbindung zwischen Molybdopterin und einem Molybdän-Oxid.
Die benötigten Molydopterine werden aus Guanosintriphosphat synthesiert (siehe Skizze an der Seite).
In Pflanzen und Tieren nutzen die Enzyme die trizyklische Seite der Molybdän-Kofaktoren. Alle modyben nutzenden, bisher entdeckten Enzyme nutzen diesen Konfaktor. Molybdän-Kofaktore, bis auf die phylogenetischen alternativen Molybdänen Nitrogenase, die Stickstoff in einigen Bakterien und Cyanobakterien binden. [3]
Molybdänische Enzyme in Pflanzen und Tieren Katalysieren die Oxidation und manchmal die Reduction von bestimmten kleinen Molekülen, als Teil der Stickstoffregulation, Schwefel und Kohlenstoffringen. [4]

Einzelnachweise
- ↑ G. Schwarz: Molybdenum cofactor biosynthesis and deficiency. In: Cell. Mol. Life Sci. Band 62, Nr. 23, Dezember 2005, S. 2792–810, doi:10.1007/s00018-005-5269-y, PMID 16261263.
- ↑ Smolinsky B, Eichler SA, Buchmeier S, Meier JC, Schwarz G: Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis. In: J. Biol. Chem. Band 283, 25, Jumi, 2008, S. 17370–9, doi:10.1074/jbc.M800985200, PMID 18411266.
- ↑ [1] Über Molybdän.
- ↑ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U; Kroneck, P.M.H: A structural comparison of molybdenum cofactor-containing enzymes. In: FEMS Microbiol. Rev. Band 22, Nr. 5, 1999, S. 503–521, doi:10.1111/j.1574-6976.1998.tb00384.x, PMID 9990727.