„Natriumhydroxymethansulfinat“ – Versionsunterschied
Rjh (Diskussion | Beiträge) AZ: Die Seite wurde neu angelegt: {{Infobox Chemikalie | Strukturformel = Datei:Rongalite.png|150px|Strukturformel von Natriumhydrox… |
(kein Unterschied)
|
Version vom 14. Dezember 2016, 20:31 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
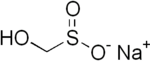
| ||||||||||
| Allgemeines | ||||||||||
| Name | Natriumhydroxymethansulfinat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | CH3NaO3S | |||||||||
| Kurzbeschreibung |
weißer Feststoff mit schwefelartigem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 118,08 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
1,744 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
leicht löslich in Wasser (1000 g·l−1 bei 25 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Natriumhydroxymethansulfinat ist eine anorganische chemische Verbindung aus der Gruppe der substituierten Sulfinsäurenderivate und Alkohole.
Gewinnung und Darstellung
Natriumhydroxymethansulfinat kann durch Reaktion von Natriumdithionit mit Formaldehyd in Gegenwart von Alkalilauge oder durch katalytische Reduktion von Natriumhydroxymethansulfonat mit Wasserstoff, sowie durch eine Reihe weiterer Darstellungsmethoden gewonnen werden.[2]
Eigenschaften
Natriumhydroxymethansulfinat ist ein brennbarer, schwer entzündbarer, hygroskopischer, weißer Feststoff mit schwefelartigem Geruch, der leicht löslich in Wasser ist. Er zersetzt sich ab 125 °C wobei Methanthiol, Schwefelwasserstoff, etwas Formaldehyd und Schwefeldioxid entstehen.[1] Er ist nach der Herstellung geruchlos, entwickelt aber schnell seinen charakteristischen Geruch. Das Dihydrat gibt kurz vor der Zersetzungstemperatur bei 120 °C sein Kristallwasser ab.[2]
Verwendung
Natriumhydroxymethansulfinat wurde ab 1905 von BASF als "Rongalit C" zum Ätzdruck von Baumwolle und für die Küpenfärberei auf den Markt gebracht.[3] In der Pharmazie wird die Verbindung als Konservierungsmittel, Antioxidans und Stabilisator in Arzneimitteln verwendet.[2]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Natriumhydroxymethansulfinat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b c Franz v. Bruchhausen, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis Folgeband 5: Stoffe L-Z. Springer-Verlag, 2013, ISBN 978-3-642-58388-9, S. 275 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Haller: Chemische Technologie der Baumwolle / Mechanische Hilfsmittel zur Veredlung der Baumwolltextilien 3. Teil. Springer-Verlag, 2013, ISBN 978-3-642-90897-2, S. 210 (eingeschränkte Vorschau in der Google-Buchsuche).

