„Azeotrop“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Komplette Überarbeitung des Artikels mit neuen Grafiken, besser erklärten Zusammenhängen & Beispielen |
|||
| Zeile 1: | Zeile 1: | ||
[[Datei:Dampf-Flüssig-Gleichgewicht Chloroform-Methanol Azeotrop.svg|mini|hochkant=2|x-y-Diagramm: Dampf-Flüssig-Gleichgewicht von [[Chloroform]] und [[Methanol]], das bei einem Mischverhältnis von 0,65 mol/mol Chloroform und 0,35 mol/mol Methanol azeotropes Verhalten zeigt.]] |
[[Datei:Dampf-Flüssig-Gleichgewicht Chloroform-Methanol Azeotrop.svg|mini|hochkant=2|x-y-Diagramm: Dampf-Flüssig-Gleichgewicht von [[Chloroform]] und [[Methanol]], das bei einem Mischverhältnis von 0,65 mol/mol Chloroform und 0,35 mol/mol Methanol azeotropes Verhalten zeigt.]] |
||
Ein '''Azeotrop''' oder '''azeotropes Gemisch''' ([[Altgriechische Sprache| |
Ein '''Azeotrop''' oder '''azeotropes Gemisch''' (vom [[Altgriechische Sprache|griechischen]] Wort ''azeotropos'' abgeleitet, das so viel wie „Sieden ohne Änderung“ bedeutet<ref name="AtkinsKurzlehrbuch">{{Literatur |Autor=[[Peter Atkins (Chemiker)|Peter W. Atkins]], [[Julio de Paula]] |Titel = Kurzlehrbuch Physikalische Chemie für natur- und ingenieurwissenschaftliche Studiengänge |Auflage=5 |Verlag = Wiley-VCH |Ort = Weinheim |Datum = 2020 | ISBN = 978-3-527-34392-8 }}</ref>) ist eine aus zwei oder mehr [[Chemische Verbindung|chemischen Verbindungen]] bestehende [[Flüssigkeit]], deren Dampfphase dieselbe Zusammensetzung hat wie die Flüssigphase. Das Gemisch hat einen konstanten [[Siedepunkt]] und lässt sich somit nicht durch einfache [[Destillation]] bzw. [[Rektifikation (Verfahrenstechnik)|Rektifikation]] trennen; es verhält sich also wie ein [[Reinstoff]]. Azeotropie ist das Gegenteil von [[Zeotropes Gemisch|Zeotropie]]. |
||
== Physikalisch-chemische Grundlagen == |
|||
== Physikalischer Hintergrund == |
|||
In azeotropen Gemischen berühren sich im ''p''-''x''-[[Phasendiagramm]] die [[Phasengrenzlinie|Siede- und die Kondensationskurven]] der Komponenten im azeotropen Mischungsverhältnis. Im ''x''-''y''-Diagramm wird die ''x''=''y''-Linie geschnitten (siehe Abbildung). |
|||
Wird ein flüssiges Gemisch aus zwei oder mehreren Stoffen betrachtet, das mit seinem eigenen Dampf im Gleichgewicht steht, so hat nach dem [[Raoultsches Gesetz]] jede Komponente des Gemisches in der Dampfphase einen [[Partialdruck]], der kleiner ist als der [[Sättigungsdampfdruck]], den sie als Reinstoff besitzt. Nach dem Raoultsches Gesetz ist also der Partialdruck jeder in der Mischung enthaltenen Komponente <math>i</math> durch das Produkt aus dem Stoffmengenanteil <math>x_i</math> und dem Gleichgewichtsdampfdruck <math>p_i^*</math>, den die Komponente als reine Substanz hat, gegeben: |
|||
Azeotrope bilden sich, wenn die [[Partialdruck|Partialdampfdrücke]] der Komponenten einer Mischflüssigkeit stark von den sich für eine ideale Mischung aus dem [[Raoultsches Gesetz|Raoultschen Gesetz]] ergebenden Dampfdrücken abweichen. |
|||
Zwei Komponenten (z. B. HCl und H<sub>2</sub>O), die miteinander stärkere Wechselwirkungen als im Reinstoff aufweisen, bilden ein Azeotrop mit Dampfdruckminimum/Siedepunktsmaximum; der Zusammenhalt zwischen einem HCl- und einem H<sub>2</sub>O-Molekül ist jeweils größer als zwischen zwei H<sub>2</sub>O-Molekülen oder zwei HCl-Molekülen. |
|||
Zwei Komponenten, wie Ethanol und Wasser, die untereinander schwächere Wechselwirkungen aufweisen als in den Reinstoffen, bilden ein Azeotrop mit Dampfdruckmaximum bzw. Siedepunktsminimum. Dies tritt typischerweise auf, wenn sich die Komponenten in ihrer [[Polarität (Chemie)|Polarität]] deutlich unterscheiden. |
|||
: <math>p_i = x_i \cdot p_i^*</math>. |
|||
Substanzen, die sich sehr ähnlich sind, wie die unterschiedlichen [[Alkane]], bilden keine Azeotrope und können destillativ sauber getrennt werden. Auch Gemische von [[Schweres Wasser|schwerem]] und [[Leichtwasser|leichtem Wasser]] lassen sich, über eine [[Kolonne (Verfahrenstechnik)|Kolonne]] mit entsprechend vielen Böden, trotz des kleinen Abstandes der Siedepunkte destillativ trennen. |
|||
Gemische, die das Raoultsches Gesetz für alle Zusammensetzungen strikt befolgen, werden als ideale Mischungen bezeichnet. In einer idealen Mischung ergibt sich das [[Chemisches Potential|chemische Potential]] der Komponenten aus der Gleichung |
|||
:<math>\mu_i(T,p) = \mu_i^\circ + RT\ln(x_i)</math>, |
|||
wobei <math>\mu_i</math> das [[Chemisches Potential|chemische Potential]] der Komponente <math>i</math> ist und <math>\mu_i^\circ</math> für das chemische Potential des Standard- bzw. Referenzzustandes steht. |
|||
Für reale Mischungen wird statt dem Stoffmengenanteil <math>x_i</math> die Aktivität <math>a_i</math> der Komponente <math>i</math> eingesetzt. |
|||
:<math>\mu_i(T,p) = \mu_i^\circ + RT\ln(a_i)</math>. |
|||
Die Aktivität selbst ist über den Aktivitätskoeffizient <math>\gamma_i</math> als Proportionalitätskonstante mit dem Stoffmengenanteil <math>x_i</math> verknüpft: |
|||
:<math>a_i = \gamma_i \cdot x_i</math>. |
|||
Somit folgt schließlich: |
|||
:<math>\mu_i(T,p) = \mu_i^\circ + RT\ln(\gamma_i x_i)</math>. |
|||
Für das Raoultsche Gesetz erhält man dann: |
|||
: <math>p_i = \gamma_i \cdot x_i \cdot p_i^* = a_i \cdot p_i^*</math>. |
|||
Azeotrope entstehen immer dann, wenn die [[Partialdruck|Partialdrücke]] der Komponenten in der Mischung stark von den Dampfdrücken, die sich für eine ideale Mischung aus dem Raoultschen Gesetz ergeben, abweichen. Genauer gesagt bedeutet das, dass die Aktivitätskoeffizienten stark vom Wert <math>\gamma_i = 1</math> abweichen, also beispielsweise deutlich größer werden. Wird ein flüssiges Gemisch zweier Komponenten <math>A</math> und <math>B</math> auf molekularer Ebene betrachtet, so kann nicht nur eine Wechselwirkung zwischen den Komponenten <math>A</math> (<math>A \leftrightarrow A</math>) oder den Komponenten <math>B</math> (<math>B \leftrightarrow B</math>) auftreten, sondern auch molekulare Interaktionen zwischen den Komponenten <math>A</math> und <math>B</math> (<math>A \leftrightarrow B</math>). Unter der Annahme idealer Mischung wären die Wechselwirkungen zwischen <math>A</math> und <math>B</math> im Mittel gleich den mittleren Wechselwirkungen der Reinstoffe <math>A</math> und <math>B</math>, wodurch sich für das Gesamtsystem energetisch nichts ändern würde. Für chemisch sehr ähnliche Moleküle (z. B. Gemisch aus [[Benzol]] und [[Toluol]]) kann diese Annahme in guter Näherung zutreffen. |
|||
In realen Mischungen können ''positive'' oder ''negative Abweichungen'' vom Raoultschen Gesetz auftreten. Nimmt der Dampfdruck einer Mischung zweier Komponenten <math>A</math> und <math>B</math> aufgrund der schwächeren zwischenmolekularen Wechselwirkungen (Abstoßungskräfte) im Vergleich zu den Reinstoffen einen größeren Wert als den idealen Wert an (Dampfdruckmaximum), so bildet sich ein Azeotrop mit Siedepunktsminimum. Die flüssige Phase wird somit durch die Wechselwirkung von <math>A</math> mit <math>B</math> destabilisiert und die [[gE-Modelle|freie Exzessenthalpie]] <math>g^E</math> ist dann positiv. Diese Abweichung von Raoultschen Gesetz wird auch als positive Abweichung bezeichnet. Beispiele für derartige Systeme sind Mischungen aus [[1,4-Dioxan]]/[[Wasser]] oder [[Ethanol]]/[[Wasser]]. Sind die Wechselwirkungen von <math>A</math> mit <math>B</math> stärker als bei den Reinstoffen (Anziehungskräfte), so führt dies zu einer Stabilisierung der Mischung relativ zum idealen Verhalten. Folglich nimmt der Dampfdruck der Mischung einen kleineren Wert als den idealen Wert an (Dampfdruckminimum) und es bildet sich ein Azeotrop mit Siedepunktsmaximum. Man spricht dann von einer negativen Abweichung vom Raoultschen Gesetz. Die [[gE-Modelle|freie Exzessenthalpie]] <math>g^E</math> ist dann negativ. Als Beispiele können die Mischungen [[Chloroform]]/[[Aceton]] oder [[Salpetersäure]]/[[Wasser]] genannt werden.<ref name="AtkinsKurzlehrbuch"/> |
|||
Bei azeotropen Gemischen berühren sich im Dampfdruck- (''p''-''x,y''-Diagramm) und Siedediagramm (''T''-''x,y''-Diagramm) die [[Phasengrenzlinie|Siede- und Kondensationskurven]] der einzelnen Komponenten im azeotropen Punkt. An diesem Punkt tritt eine Umkehr der relativen Flüchtigkeiten ein und der [[Trennfaktor]] <math>\alpha</math> nimmt den Wert 1 an. In einem bestimmten Bereich diesseits und jenseits des azeotropen Punktes ist Komponente <math>A</math> die leichtflüchtigere, im anderen Bereich ist Komponente <math>B</math> die leichtflüchtigere und reichert sich in der Dampfphase an.<ref name="ChemischTechnischesLexikon">{{Literatur |Autor=Dieter Osterroth |Titel = Chemisch-Technisches Lexikon |Auflage=5 |Verlag = Springer Verlag |Ort = Berlin, Heidelberg, NewYork |Datum = 1979 | ISBN = 978-3-642-67010-7 }}</ref> |
|||
== Einteilung von Azeotropen == |
|||
== Azeotroptypen == |
|||
=== Druckminimum oder Druckmaximum === |
=== Druckminimum oder Druckmaximum === |
||
Man unterscheidet zwei unterschiedliche Arten von Azeotropen: |
|||
| ⚫ | * Das '''positive Azeotrop''' entspricht im [[Phasendiagramm|''p |
||
| ⚫ | * Das '''negative Azeotrop''' entspricht im ''p |
||
Je nachdem, ob eine positive (<math>\gamma > 1 </math>) oder negative (<math>\gamma < 1 </math>) Abweichung vom Raoultschen Gesetz vorliegt, können Azeotrope in positive oder negative Azeotrope eingeteilt werden. |
|||
| ⚫ | |||
Vapor-pressure-composition diagram of chloroform methanol.svg|Druckmaximum-Azeotrop Chloroform/Methanol<br /> P,x,y-Diagramm, T = 20 °C |
|||
| ⚫ | * Das '''positive Azeotrop''' entspricht im [[Phasendiagramm|''p-x,y''-Diagramm]] dem Stoffgemisch am ''[[Extremwert|Maximum]]'' des [[Dampfdruck]]s. Der [[Siedepunkt]] dieses Gemisches besitzt im [[Phasendiagramm|''T,x-y''-Diagramm]] ein ''Minimum'' und liegt ''unter'' denjenigen der beteiligten Reinstoffe. Im Folgenden ist als Beispiel das System [[Chloroform]]/[[Methanol]] gezeigt. |
||
Azeotrop2-Butanon1,2-Dichlorethan.png|Druckminimum-Azeotrop<br /> 2-Butanon/1,2-Dichlorethan<br /> P,x,y-Diagramm, T = 60 °C |
|||
<gallery mode="packed" heights="300" perrow="2" caption="Dampfdruck- und Siedepunktsdiagramm eines positiven Azeotrops"> |
|||
Vapor-pressure-composition diagram of chloroform methanol.svg|Dampfdruckdiagramm (''p''-''x,y''-Diagramm) einer Mischung aus Chloroform und Methanol mit Dampfdruck''maximum'' |
|||
Boiling-point-composition diagram of chloroform methanol.svg|Siedediagramm (''T''-''x,y''-Diagramm) einer Mischung aus Chloroform und Methanol mit Siedepunkts''minimum'' |
|||
</gallery> |
</gallery> |
||
| ⚫ | * Das '''negative Azeotrop''' entspricht im ''p-x,y''-Diagramm dem Stoffgemisch am ''Minimum'' des Dampfdrucks. Der [[Siedepunkt]] dieses Gemisches besitzt im [[Phasendiagramm|''T-x,y''-Diagramm]] ein ''Maximum'' und liegt ''über'' denjenigen der beteiligten Reinstoffe. Als Beispiel ist eine Mischung aus [[Chloroform]] und [[Aceton]] gezeigt. |
||
=== Heteroazeotrop oder homogenes Azeotrop === |
|||
Bei Komponenten, die sich nicht vollständig ineinander lösen, kann ein Azeotrop in der [[Mischungslücke]] liegen. In diesem Fall wird von einem Heteroazeotrop gesprochen. Für den Fall, dass die azeotrope Zusammensetzung sich im mischbaren Bereich befindet, oder die Komponenten beliebig mischbar sind, wird von einem homogenen Azeotrop gesprochen. |
|||
<gallery mode="packed" heights="300" perrow="2" caption="Dampfdruck- und Siedepunktsdiagramm eines negativen Azeotrops"> |
|||
<gallery> |
|||
Vapor-pressure-composition diagram of chloroform acetone.svg|Dampfdruckdiagramm (''p''-''x,y''-Diagramm) einer Mischung aus Chloroform und Aceton mit Dampfdruck''minimum'' |
|||
VLE Wasser+1-Pentanol mit Heteroazetrop.png|[[Dampf-Flüssigkeit-Gleichgewicht|Dampf-Flüssig-Gleichgewicht]]<br />Wasser/1-Pentanol |
|||
Boiling-point-composition diagram of chloroform acetone.svg|Siedediagramm (''T''-''x,y''-Diagramm) einer Mischung aus Chloroform und Aceton mit Siedepunkts''maximum'' |
|||
Mischungslücke Wasser+1-Pentanol mit Heteroazeotrop.png|Flüssig-Flüssig-Gleichgewicht<br />Wasser/1-Pentanol |
|||
Ethanol-Wasser-Benzol-LLE-Heteroazetrop.png|Dampf-Flüssig-Gleichgewicht<br />Wasser-Ethanol-Benzol |
|||
</gallery> |
</gallery> |
||
=== Homogenes Azeotrop oder Heteroazeotrop === |
|||
| ⚫ | Bei einem Heteroazeotrop haben die Flüssigkeit und der Dampf nicht die gleiche Zusammensetzung, da die flüssige Phase bei der azeotropen Zusammensetzung instabil ist und in zwei Phasen zerfällt. |
||
* Von einem '''homogenen Azeotrop''' wird gesprochen, wenn sich die azeotrope Zusammensetzung im mischbaren Bereich befindet oder die Komponenten beliebig miteinander mischbar sind. Als Beispiel für ein homogenes Azeotrop kann das Gemisch aus [[Ethanol]]/[[Wasser]] herangezogen werden. |
|||
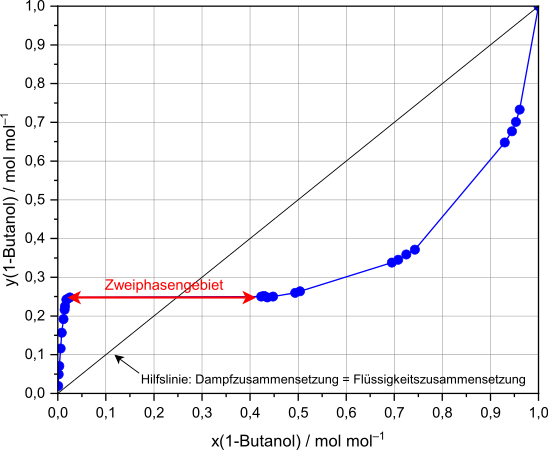
* Von einem '''heterogenen Azeotrop''' (Heteroazeotrop) wird gesprochen, wenn sich die Komponenten nicht vollständig ineinander lösen. Bei diesem Fall kann das Azeotrop bzw. der azeotrope Punkt in der [[Mischungslücke]] liegen. Werden die Werte der Aktivitätskoeffizienten noch größer (<math>\gamma >> 1 </math>), so führt dies in der Regel zum Auftreten von zwei flüssigen Phasen. Ein Heteroazeotrop ist weiterhin dadurch gekennzeichnet, dass das Zweiphasengebiet (waagerechte Linie) die Diagonale im ''x''-''y''-Diagramm schneidet. |
|||
<gallery mode="packed" heights="300" perrow="2" caption="Siedepunktsdiagramm und Dampf-Flüssig-Gleichgewicht eines Heteroazeotrops"> |
|||
Siedepunkt-Zusammensetzung-Diagramm von 1-Butanol Wasser.svg|Siedepunktsdiagramm (''T''-''x,y''-Diagramm) einer Mischung aus [[1-Butanol]] und [[Wasser]] mit Mischungslücke |
|||
Dampf-Flüssig-Gleichgewicht 1-Butanol-Wasser.svg|Dampf-Flüssig-Gleichgewicht (''x-y''-Diagramm) einer Mischung aus [[1-Butanol]] und [[Wasser]] mit Zweiphasengebiet |
|||
| ⚫ | |||
| ⚫ | Bei einem Heteroazeotrop haben die Flüssigkeit und der Dampf nicht die gleiche Zusammensetzung, da die flüssige Phase bei der azeotropen Zusammensetzung instabil ist und in zwei Phasen zerfällt. Wird der Dampf mit heteroazeotroper Zusammensetzung auskondensiert, so entmischen sich die beiden Komponenten in eine Komponente A-reiche und eine Komponente B-reiche Phase (Mischungslücke). |
||
=== Sattelazeotrop === |
=== Sattelazeotrop === |
||
| Zeile 47: | Zeile 84: | ||
!Quelle |
!Quelle |
||
|- |
|- |
||
||331,02||101,325||0,316||0,238||0,446||<ref>H. Lang |
||331,02||101,325||0,316||0,238||0,446||<ref name="Lang">H. Lang, "Über das Siedegleichgewicht des Systems Methanol-Aceton-Chloroform", ''[[Zeitschrift für Physikalische Chemie|Z. Phys. Chem.]]'' '''1950''', ''196'', 278–297. {{DOI|10.1515/zpch-1950-19624}}</ref> |
||
|} |
|} |
||
| Zeile 54: | Zeile 91: | ||
Die Bezeichnung „Sattelazeotrop“ leitet sich direkt aus der Form des dreidimensional gezeichneten Dampf-Flüssigkeit-Gleichgewichts ab. |
Die Bezeichnung „Sattelazeotrop“ leitet sich direkt aus der Form des dreidimensional gezeichneten Dampf-Flüssigkeit-Gleichgewichts ab. |
||
== |
== Thermische Trennverfahren azeotroper Gemische == |
||
Da azeotrope Gemische aus Bestandteilen mit recht unterschiedlichen Eigenschaften bestehen |
Bei engsiedenden Gemischen, deren [[Trennfaktor]] nur wenig vom Wert eins abweicht, ist für die Trennung durch [[Rektifikation (Verfahrenstechnik)|Rektifikation]] entweder eine hohe Zahl an theoretischen Trennstufen oder ein hohes Rücklaufverhältnis nötig, was zu hohen Investitions- und Betriebskosten führt. Nimmt der Trennfaktor gar den Wert <math>\alpha = 1</math> an, liegt ein azeotropes Gemisch vor. Bei azeotropen Gemischen reicht selbst eine unendliche Anzahl theoretischer Trennstufen nicht mehr aus, um die Komponenten zu trennen. Da azeotrope Gemische aus Bestandteilen mit recht unterschiedlichen Eigenschaften bestehen, lassen sie sich meist leicht durch andere gängige Trennmethoden außer Rektifikation auftrennen. Beispiele wären [[Chromatographie]], Zugabe geeigneter [[Molekularsieb]]e oder [[Trocknungsmittel|Trockenmittel]] wie [[Magnesiumsulfat]], [[Kristallisation|Auskristallisieren]] einer Komponente bei niedrigen Temperaturen. |
||
Um azeotrope Gemische trotzdem durch Destillation bzw. Rektifikation trennen zu können, sind Sonderverfahren nötig. Die vereinfachte Gleichung für den Trennfaktor <math>\alpha_{12}</math> ist über das Verhältnis der [[Verteilungskoeffizient]]en <math>K_i</math> gegeben, die sich wiederum aus den [[Aktivität (Chemie)|Aktivitätskoeffizienten]] <math>\gamma_i</math> und den [[Sättigungsdampfdruck|Sättigungsdampfdrücken]] <math>p_i^S</math> zusammensetzen: |
|||
=== Azeotrope Rektifikation === |
|||
{{Hauptartikel|Azeotroprektifikation}} |
|||
:<math>\alpha = \frac{K_1}{K_2} = \frac{\gamma_1 p_1^S}{\gamma_2 p_2^S}</math> |
|||
Beim mehrfachen Destillieren eines Ethanol-Wasser-Gemisches erhält man ein Azeotrop aus ca. 96 % Ethanol und 4 % Wasser, <!-- Genaue %, siehe Diskussion. Alex42 13.5.2020 -->das durch Destillation nicht weiter zu trennen ist und bei 78,17 °C siedet. |
|||
Da sowohl die Sättigungsdampfdrücke als auch die Aktivitätskoeffizienten von der Temperatur abhängig sind, kann der Trennfaktor durch eine Temperaturänderung (und damit verbundene Druckänderung) beeinflusst werden. Folglich kann die azeotrope Zusammensetzung durch eine Druckänderung (Temperaturänderung) stark verändert werden oder das azeotrope Verhalten gänzlich verschwinden. Dieses Phänomen kann bei der Rektifikation eines azeotropen Gemisches in zwei [[Rektifikationskolonne]]n, die bei unterschiedlichen Drücken betrieben werden, ausgenutzt werden. Das Verfahren wird dann als [[Zweidruckverfahren]] bezeichnet. Weitere elegante Methoden zur Trennung azeotroper Gemische bestehen in der Zugabe eines Zusatzstoffes (Entrainer) wie bei der [[Extraktivrektifikation|extraktiven Rektifikation]] und der [[Azeotroprektifikation|azeotropen Rektifikation]]. |
|||
Durch Zusatz einer dritten Komponente kann dieses Azeotrop jedoch getrennt werden. So bildet das Wasser-Ethanol-Gemisch durch Zugabe von [[Benzol]] ein Azeotrop mit drei Komponenten (ein [[ternäres Azeotrop]]), das bei 64,9 °C siedet. Nun kann dieses Wasser-Benzol-Ethanol-Gemisch abdestilliert und somit das Wasser nach und nach aus der flüssigen Phase ausgeschleppt werden. Zurück bleibt ein Benzol-Ethanol-Gemisch, von dem sich das Benzol durch normale Destillation abtrennen lässt, sodass man wasserfreies Ethanol erhält. |
|||
=== Dampfpermeation und Pervaporation === |
=== Dampfpermeation und Pervaporation === |
||
| Zeile 69: | Zeile 105: | ||
Im Unterschied zur Dampfpermeation wird bei der [[Pervaporation]] das flüssige Gemisch an der Membran vorbeigeführt. |
Im Unterschied zur Dampfpermeation wird bei der [[Pervaporation]] das flüssige Gemisch an der Membran vorbeigeführt. |
||
== Azeotrope Destillation == |
|||
Die Bildung von Azeotropen kann genutzt werden, um einen Stoff aus einem Gemisch „herauszuschleppen“. Beispielsweise wird in der chemischen Reaktionstechnik zur Abtrennung von Wasser aus einem Reaktionsgemisch häufig [[Toluol]] als [[Schleppmittel]] eingesetzt. Toluol bildet mit Wasser ein Minimum-Azeotrop. Im [[Kondensation|Kondensat]] entmischen sich die beiden Flüssigkeiten wieder und bilden zwei Phasen. Das Toluol, die obere Phase, wird durch einen [[Wasserabscheider]] im Kreislauf der Reaktion wieder zugeführt. Das Wasser wird abgetrennt, und anhand der gebildeten Wassermenge kann der Reaktionsverlauf beobachtet werden. |
|||
== Siehe auch == |
== Siehe auch == |
||
| Zeile 80: | Zeile 113: | ||
* [http://www.pci.uni-heidelberg.de/pci/hvolpp/images/pc2_ss05/Azeotrope_nichtideale_Mischungen.pdf ''Azeotrope, Nichtideale Mischungen''.] (PDF; 139 kB) Uni Paderborn, auf Server der Uni Heidelberg |
* [http://www.pci.uni-heidelberg.de/pci/hvolpp/images/pc2_ss05/Azeotrope_nichtideale_Mischungen.pdf ''Azeotrope, Nichtideale Mischungen''.] (PDF; 139 kB) Uni Paderborn, auf Server der Uni Heidelberg |
||
* [http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/13/vlu/thermodyn/phasen/destillation.vlu/Page/vsc/de/ch/13/pc/thermodyn/phasen/rektifikation.vscml.html Chemgapedia] (Animation) |
* [http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/13/vlu/thermodyn/phasen/destillation.vlu/Page/vsc/de/ch/13/pc/thermodyn/phasen/rektifikation.vscml.html Chemgapedia] (Animation) |
||
== Literatur == |
|||
* {{Literatur |Autor=[[Gerd Wedler]], [[Hans-Joachim Freund (Chemiker)|Hans-Joachim Freund]] |Titel=Lehr- und Arbeitsbuch Physikalische Chemie |Auflage=7 |Verlag=Wiley-VCH |Ort=Weinheim |Datum=2018 |ISBN=978-3-527-34611-0 }} |
|||
* {{Literatur |Autor=[[Peter Atkins (Chemiker)|Peter W. Atkins]], [[Julio de Paula]] |Titel = Physikalische Chemie |Auflage=5 |Verlag = Wiley-VCH |Ort = Weinheim |Datum = 2013 | ISBN = 978-3-527-33247-2 }} |
|||
* {{Literatur |Autor=[[Manfred Baerns]], [[Arno Behr (Chemiker, 1952)|Arno Behr]], Axel Brehm, [[Jürgen Gmehling]], Kai-Olaf Hinrichsen, [[Hanns Hofmann (Chemiker)|Hanns Hofmann]], Regina Palkovits, [[Ulfert Onken]], Albert Renken |Titel=Technische Chemie |Auflage=2 |Verlag=Wiley-VCH |Ort=Weinheim |Datum=2013 |ISBN=978-3-527-33072-0 }} |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
<references /> |
<references /> |
||
[[Kategorie:Thermodynamik]] |
|||
Version vom 10. Dezember 2022, 22:19 Uhr

Ein Azeotrop oder azeotropes Gemisch (vom griechischen Wort azeotropos abgeleitet, das so viel wie „Sieden ohne Änderung“ bedeutet[1]) ist eine aus zwei oder mehr chemischen Verbindungen bestehende Flüssigkeit, deren Dampfphase dieselbe Zusammensetzung hat wie die Flüssigphase. Das Gemisch hat einen konstanten Siedepunkt und lässt sich somit nicht durch einfache Destillation bzw. Rektifikation trennen; es verhält sich also wie ein Reinstoff. Azeotropie ist das Gegenteil von Zeotropie.
Physikalisch-chemische Grundlagen
Wird ein flüssiges Gemisch aus zwei oder mehreren Stoffen betrachtet, das mit seinem eigenen Dampf im Gleichgewicht steht, so hat nach dem Raoultsches Gesetz jede Komponente des Gemisches in der Dampfphase einen Partialdruck, der kleiner ist als der Sättigungsdampfdruck, den sie als Reinstoff besitzt. Nach dem Raoultsches Gesetz ist also der Partialdruck jeder in der Mischung enthaltenen Komponente durch das Produkt aus dem Stoffmengenanteil und dem Gleichgewichtsdampfdruck , den die Komponente als reine Substanz hat, gegeben:
- .
Gemische, die das Raoultsches Gesetz für alle Zusammensetzungen strikt befolgen, werden als ideale Mischungen bezeichnet. In einer idealen Mischung ergibt sich das chemische Potential der Komponenten aus der Gleichung
- ,
wobei das chemische Potential der Komponente ist und für das chemische Potential des Standard- bzw. Referenzzustandes steht.
Für reale Mischungen wird statt dem Stoffmengenanteil die Aktivität der Komponente eingesetzt.
- .
Die Aktivität selbst ist über den Aktivitätskoeffizient als Proportionalitätskonstante mit dem Stoffmengenanteil verknüpft:
- .
Somit folgt schließlich:
- .
Für das Raoultsche Gesetz erhält man dann:
- .
Azeotrope entstehen immer dann, wenn die Partialdrücke der Komponenten in der Mischung stark von den Dampfdrücken, die sich für eine ideale Mischung aus dem Raoultschen Gesetz ergeben, abweichen. Genauer gesagt bedeutet das, dass die Aktivitätskoeffizienten stark vom Wert abweichen, also beispielsweise deutlich größer werden. Wird ein flüssiges Gemisch zweier Komponenten und auf molekularer Ebene betrachtet, so kann nicht nur eine Wechselwirkung zwischen den Komponenten () oder den Komponenten () auftreten, sondern auch molekulare Interaktionen zwischen den Komponenten und (). Unter der Annahme idealer Mischung wären die Wechselwirkungen zwischen und im Mittel gleich den mittleren Wechselwirkungen der Reinstoffe und , wodurch sich für das Gesamtsystem energetisch nichts ändern würde. Für chemisch sehr ähnliche Moleküle (z. B. Gemisch aus Benzol und Toluol) kann diese Annahme in guter Näherung zutreffen.
In realen Mischungen können positive oder negative Abweichungen vom Raoultschen Gesetz auftreten. Nimmt der Dampfdruck einer Mischung zweier Komponenten und aufgrund der schwächeren zwischenmolekularen Wechselwirkungen (Abstoßungskräfte) im Vergleich zu den Reinstoffen einen größeren Wert als den idealen Wert an (Dampfdruckmaximum), so bildet sich ein Azeotrop mit Siedepunktsminimum. Die flüssige Phase wird somit durch die Wechselwirkung von mit destabilisiert und die freie Exzessenthalpie ist dann positiv. Diese Abweichung von Raoultschen Gesetz wird auch als positive Abweichung bezeichnet. Beispiele für derartige Systeme sind Mischungen aus 1,4-Dioxan/Wasser oder Ethanol/Wasser. Sind die Wechselwirkungen von mit stärker als bei den Reinstoffen (Anziehungskräfte), so führt dies zu einer Stabilisierung der Mischung relativ zum idealen Verhalten. Folglich nimmt der Dampfdruck der Mischung einen kleineren Wert als den idealen Wert an (Dampfdruckminimum) und es bildet sich ein Azeotrop mit Siedepunktsmaximum. Man spricht dann von einer negativen Abweichung vom Raoultschen Gesetz. Die freie Exzessenthalpie ist dann negativ. Als Beispiele können die Mischungen Chloroform/Aceton oder Salpetersäure/Wasser genannt werden.[1]
Bei azeotropen Gemischen berühren sich im Dampfdruck- (p-x,y-Diagramm) und Siedediagramm (T-x,y-Diagramm) die Siede- und Kondensationskurven der einzelnen Komponenten im azeotropen Punkt. An diesem Punkt tritt eine Umkehr der relativen Flüchtigkeiten ein und der Trennfaktor nimmt den Wert 1 an. In einem bestimmten Bereich diesseits und jenseits des azeotropen Punktes ist Komponente die leichtflüchtigere, im anderen Bereich ist Komponente die leichtflüchtigere und reichert sich in der Dampfphase an.[2]
Einteilung von Azeotropen
Druckminimum oder Druckmaximum
Je nachdem, ob eine positive () oder negative () Abweichung vom Raoultschen Gesetz vorliegt, können Azeotrope in positive oder negative Azeotrope eingeteilt werden.
- Das positive Azeotrop entspricht im p-x,y-Diagramm dem Stoffgemisch am Maximum des Dampfdrucks. Der Siedepunkt dieses Gemisches besitzt im T,x-y-Diagramm ein Minimum und liegt unter denjenigen der beteiligten Reinstoffe. Im Folgenden ist als Beispiel das System Chloroform/Methanol gezeigt.
- Dampfdruck- und Siedepunktsdiagramm eines positiven Azeotrops
-
Dampfdruckdiagramm (p-x,y-Diagramm) einer Mischung aus Chloroform und Methanol mit Dampfdruckmaximum
-
Siedediagramm (T-x,y-Diagramm) einer Mischung aus Chloroform und Methanol mit Siedepunktsminimum
- Das negative Azeotrop entspricht im p-x,y-Diagramm dem Stoffgemisch am Minimum des Dampfdrucks. Der Siedepunkt dieses Gemisches besitzt im T-x,y-Diagramm ein Maximum und liegt über denjenigen der beteiligten Reinstoffe. Als Beispiel ist eine Mischung aus Chloroform und Aceton gezeigt.
- Dampfdruck- und Siedepunktsdiagramm eines negativen Azeotrops
-
Dampfdruckdiagramm (p-x,y-Diagramm) einer Mischung aus Chloroform und Aceton mit Dampfdruckminimum
-
Siedediagramm (T-x,y-Diagramm) einer Mischung aus Chloroform und Aceton mit Siedepunktsmaximum
Homogenes Azeotrop oder Heteroazeotrop
- Von einem homogenen Azeotrop wird gesprochen, wenn sich die azeotrope Zusammensetzung im mischbaren Bereich befindet oder die Komponenten beliebig miteinander mischbar sind. Als Beispiel für ein homogenes Azeotrop kann das Gemisch aus Ethanol/Wasser herangezogen werden.
- Von einem heterogenen Azeotrop (Heteroazeotrop) wird gesprochen, wenn sich die Komponenten nicht vollständig ineinander lösen. Bei diesem Fall kann das Azeotrop bzw. der azeotrope Punkt in der Mischungslücke liegen. Werden die Werte der Aktivitätskoeffizienten noch größer (), so führt dies in der Regel zum Auftreten von zwei flüssigen Phasen. Ein Heteroazeotrop ist weiterhin dadurch gekennzeichnet, dass das Zweiphasengebiet (waagerechte Linie) die Diagonale im x-y-Diagramm schneidet.
- Siedepunktsdiagramm und Dampf-Flüssig-Gleichgewicht eines Heteroazeotrops
Bei einem Heteroazeotrop haben die Flüssigkeit und der Dampf nicht die gleiche Zusammensetzung, da die flüssige Phase bei der azeotropen Zusammensetzung instabil ist und in zwei Phasen zerfällt. Wird der Dampf mit heteroazeotroper Zusammensetzung auskondensiert, so entmischen sich die beiden Komponenten in eine Komponente A-reiche und eine Komponente B-reiche Phase (Mischungslücke).
Sattelazeotrop

(berechnet mit mod. UNIFAC)
Ein Sattelazeotrop tritt nur in ternären und höheren Gemischen auf. Es zeichnet sich dadurch aus, dass das ternäre (oder höhere) Azeotrop zwischen den Siedepunkten der reinen Stoffe liegt und damit weder ein Druckmaximum- noch ein Druckminimumazeotrop bildet.
Ein typisches Beispiel ist das ternäre Gemisch aus Chloroform, Methanol und Aceton. Das ternäre Azeotrop liegt dabei bei
| T / K | P / kPa | xAceton | xChloroform | xMethanol | Quelle |
|---|---|---|---|---|---|
| 331,02 | 101,325 | 0,316 | 0,238 | 0,446 | [3] |
In diesem System bilden auch alle binären Subsysteme Azeotrope, Aceton/Chloroform ein Druckminimum-, Aceton/Methanol und Methanol/Chloroform ein Druckmaximumazeotrop.
Die Bezeichnung „Sattelazeotrop“ leitet sich direkt aus der Form des dreidimensional gezeichneten Dampf-Flüssigkeit-Gleichgewichts ab.
Thermische Trennverfahren azeotroper Gemische
Bei engsiedenden Gemischen, deren Trennfaktor nur wenig vom Wert eins abweicht, ist für die Trennung durch Rektifikation entweder eine hohe Zahl an theoretischen Trennstufen oder ein hohes Rücklaufverhältnis nötig, was zu hohen Investitions- und Betriebskosten führt. Nimmt der Trennfaktor gar den Wert an, liegt ein azeotropes Gemisch vor. Bei azeotropen Gemischen reicht selbst eine unendliche Anzahl theoretischer Trennstufen nicht mehr aus, um die Komponenten zu trennen. Da azeotrope Gemische aus Bestandteilen mit recht unterschiedlichen Eigenschaften bestehen, lassen sie sich meist leicht durch andere gängige Trennmethoden außer Rektifikation auftrennen. Beispiele wären Chromatographie, Zugabe geeigneter Molekularsiebe oder Trockenmittel wie Magnesiumsulfat, Auskristallisieren einer Komponente bei niedrigen Temperaturen.
Um azeotrope Gemische trotzdem durch Destillation bzw. Rektifikation trennen zu können, sind Sonderverfahren nötig. Die vereinfachte Gleichung für den Trennfaktor ist über das Verhältnis der Verteilungskoeffizienten gegeben, die sich wiederum aus den Aktivitätskoeffizienten und den Sättigungsdampfdrücken zusammensetzen:
Da sowohl die Sättigungsdampfdrücke als auch die Aktivitätskoeffizienten von der Temperatur abhängig sind, kann der Trennfaktor durch eine Temperaturänderung (und damit verbundene Druckänderung) beeinflusst werden. Folglich kann die azeotrope Zusammensetzung durch eine Druckänderung (Temperaturänderung) stark verändert werden oder das azeotrope Verhalten gänzlich verschwinden. Dieses Phänomen kann bei der Rektifikation eines azeotropen Gemisches in zwei Rektifikationskolonnen, die bei unterschiedlichen Drücken betrieben werden, ausgenutzt werden. Das Verfahren wird dann als Zweidruckverfahren bezeichnet. Weitere elegante Methoden zur Trennung azeotroper Gemische bestehen in der Zugabe eines Zusatzstoffes (Entrainer) wie bei der extraktiven Rektifikation und der azeotropen Rektifikation.
Dampfpermeation und Pervaporation
Eine weitere Möglichkeit, ein azeotropes Ethanol-Wasser-Gemisch zu trennen, ist die Dampfpermeation. Dabei wird das Gemisch verdampft und durch eine Membraneinheit geführt. Die Membran funktioniert wie ein Filter, d. h., deren Poren lassen nur eine Komponente passieren – hier also das Wasser. Treibende Kraft für die Trennung des Gemisches ist ein Druckunterschied zwischen dem Innenraum und dem Außenraum und die Selektivität der Membran. Somit tritt das Wasser durch die Membran durch (Permeat) und das wasserfreie Ethanol bleibt auf der anderen Seite der Membran (Retentat). So kann man Ethanol mit einer Reinheit von bis zu 99,97 % erhalten.
Im Unterschied zur Dampfpermeation wird bei der Pervaporation das flüssige Gemisch an der Membran vorbeigeführt.
Siehe auch
- Dortmunder Datenbank – Datenbank für azeotrope und zeotrope Systeme
Weblinks
- Azeotrope, Nichtideale Mischungen. (PDF; 139 kB) Uni Paderborn, auf Server der Uni Heidelberg
- Chemgapedia (Animation)
Literatur
- Gerd Wedler, Hans-Joachim Freund: Lehr- und Arbeitsbuch Physikalische Chemie. 7. Auflage. Wiley-VCH, Weinheim 2018, ISBN 978-3-527-34611-0.
- Peter W. Atkins, Julio de Paula: Physikalische Chemie. 5. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33247-2.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33072-0.
Einzelnachweise
- ↑ a b Peter W. Atkins, Julio de Paula: Kurzlehrbuch Physikalische Chemie für natur- und ingenieurwissenschaftliche Studiengänge. 5. Auflage. Wiley-VCH, Weinheim 2020, ISBN 978-3-527-34392-8.
- ↑ Dieter Osterroth: Chemisch-Technisches Lexikon. 5. Auflage. Springer Verlag, Berlin, Heidelberg, NewYork 1979, ISBN 978-3-642-67010-7.
- ↑ H. Lang, "Über das Siedegleichgewicht des Systems Methanol-Aceton-Chloroform", Z. Phys. Chem. 1950, 196, 278–297. doi:10.1515/zpch-1950-19624