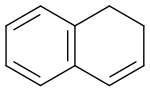
1,2-Dihydronaphthalin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,2-Dihydronaphthalin | ||||||||||||||||||
| Andere Namen |
Δ1-Dialin | ||||||||||||||||||
| Summenformel | C10H10 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 130,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,991 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
207 °C[1] | ||||||||||||||||||
| Brechungsindex |
1,5814 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1,2-Dihydronaphthalin ist eine chemische Verbindung aus der Gruppe der bicyclisches Verbindungen. Es ist ein Cyclohexa-1,3-dien, bei dem eine Doppelbindung durch einen Benzolring ersetzt wurde.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
1,2-Dihydronaphthalin kann durch Reaktion von 1,2-Dibromtetralin mit Magnesium in Diethylether gewonnen werden.[4]
Die Verbindung kann auch aus dem instabilen Isomer 1,4-Dihydronaphthalin gewonnen werden, da dieses mit einer Lösung von Natriumethoxid in Ethanol zu 1,2-Dihydronaphthalin isomerisieren kann.[5]
Daneben sind noch weitere Syntheseverfahren bekannt.[6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
1,2-Dihydronaphthalin ist eine farblose bis gelbliche Flüssigkeit.[1] Die Verbindung zersetzt sich unter Stickstoff bei Temperaturen ab etwa 300 °C.[7][8] Auch unter UV-Licht zersetzt sich die Verbindung.[9]
Verwendung[Bearbeiten | Quelltext bearbeiten]
1,2-Dihydronaphthalin wird als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen verwendet.[10][11][12]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu 1,2-Dihydronaphthalin, >98.0% bei TCI Europe, abgerufen am 8. Oktober 2023.
- ↑ Robert D. Chirico, William V. Steele: Thermodynamic properties of 1,2-dihydronaphthalene: Glassy crystals and missing entropy. In: The Journal of Chemical Thermodynamics. Band 40, Nr. 5, 2008, S. 806–817, doi:10.1016/j.jct.2008.01.009.
- ↑ CRC Handbook of Chemistry and Physics. CRC Press, ISBN 978-1-4987-5429-3, S. 3–186 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Julius V. Braun, Erich Hahn, Jon Seemann: Über Benzo‐polymethylen‐Verbindungen, III.: Dehydrierungsversuche bei Tetralin‐, Hydrinden‐ und Tetrahydro‐acenaphthen‐(Tetraphthen‐)Derivaten. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 55, Nr. 6, 1922, S. 1687–1700, doi:10.1002/cber.19220550623.
- ↑ Amit Arora: Aromatic Organic Chemistry. Discovery Publishing House, New Delhi 2006, ISBN 81-8356-202-7, S. 167 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. J. Köhler, W. N. Speckamp: Formation of a 1,2-dihydronaphthalene via methylene radical attack on a naphthalene nucleus. In: Tetrahedron Letters. Band 18, Nr. 7, 1977, S. 635–638, doi:10.1016/S0040-4039(01)92712-1.
- ↑ D. T. Allen, G. R. Gavalas: Kinetics of dialin thermolysis. In: International Journal of Chemical Kinetics. Band 15, Nr. 3, 1983, S. 219–233, doi:10.1002/kin.550150303.
- ↑ Pierre Bredael, Tran Huu Vinh: Pyrolysis of hydronaphthalenes. 1. Pyrolysis of tetralin, 1,2-dihydronaphthalene and 2-methylindene. In: Fuel. Band 58, Nr. 3, 1979, S. 211–214, doi:10.1016/0016-2361(79)90120-0.
- ↑ K. Salisbury: The photochemistry of 1,2-dihydronaphthalene. In: Tetrahedron Letters. Band 12, Nr. 10, 1971, S. 737–739, doi:10.1016/S0040-4039(01)96545-1.
- ↑ Mike D. Cagle, Sharbil J. Firsan, E. J. Eisenbraun: Purification of 1,2-dihydronaphthalene- an Important Intermediate in the Hydroprocessing of Naphthalene. In: Organic Preparations and Procedures International. Band 26, Nr. 3, 1994, S. 370–373, doi:10.1080/00304949409458441.
- ↑ H. H. King, L. M. Stock: Hydrogen transfer reactions of 1,2- and 1,4-dihydronaphthalene. In: Fuel; (United Kingdom). Band 60:8, 1981 (osti.gov).
- ↑ Kenji Maeda, Edward J. Farrington, Erwan Galardon, Benjamin D. John, John M. Brown: Competing Regiochemical Pathways in the Heck Arylation of 1,2-Dihydronaphthalene. In: Advanced Synthesis & Catalysis. Band 344, Nr. 1, 2002, S. 104, doi:10.1002/1615-4169(200201)344:1<104::AID-ADSC104>3.0.CO;2-V (wiley.com).