Calciumdisilicid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
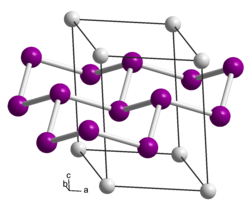
| ||||||||||||||||
| _ Ca2+ _ Si− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Calciumdisilicid | |||||||||||||||
| Andere Namen |
Calciumsilicid (mehrdeutig) | |||||||||||||||
| Verhältnisformel | CaSi2 | |||||||||||||||
| Kurzbeschreibung |
grauer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 96,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,47 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Calciumdisilicid ist eine anorganische chemische Verbindung von Calciums mit Silicium und eines der bekannten Calciumsilicide. Es ist eine Zintl-Phase.[5]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Calciumdisilicid kann durch Reaktion von Calcium oder Calciumhydrid mit Silicium in einer Wasserstoffatmosphäre bei etwa 1000 °C,
durch Reaktion von Siliciumdioxid mit Calcium oder durch Reduktion eines Gemisches von Calciumoxid und Siliciumdioxid mit Kohlenstoff gewonnen werden.[6][7]
Es kann auch durch Reduktion von Siliciumdioxid mit Koks in Anwesenheit von Calciumcarbid gewonnen werden.[8]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Calciumdisilicid ist ein grauer Feststoff.[1] Die von Friedrich Wöhler 1863 entdeckte Verbindung wurde von J. Böhm und O. Hassel 1927 röntgenographisch untersucht. Danach kristallisiert es trigonal/rhomboedrisch in der Raumgruppe R3m (Raumgruppen-Nr. 166) mit den trigonalen Achsen a = 3,86 Å und c = 30,6 Å. Die Struktur lässt sich als gewellte Sechsringgitter[8] aus Siliciumschichten beschreiben, zwischen denen die Calciumatome liegen. Eine Nachprüfung hat gezeigt, dass aus reinem Calcium und reinem Silicium eine andere Calciumdisilicidphase entsteht. Danach hat das reine Calciumdisilicid zwar die gleiche Symmetrie, aber nur etwa die halbe Identitätsperiode in der c-Richtung.[2][9][10] Ein Polytyp in der Raumgruppe P3m1 (Nr. 164) und den Gitterparametern a = 3,85 Å und c = 5,20 Å ist ebenfalls bekannt.[11] Es existiert auch eine tetragonale Hochtemperaturvariante bzw. Hochdruckvariante mit der Raumgruppe I41/amd (Nr. 141)[12][13] vom α-Thoriumdisilicidtyp bekannt. Die Umwandlung in die Hochtemperaturform findet zwischen 600 und 1000 °C statt, die Rückumwandlung bei Abkühlung unter 530 °C.[14] Über 16 GPa findet eine weitere Phasenänderung zum Aluminiumdiboridtyp statt.[15]
Mit Chlorwasserstoff in Ethanol reagiert Calciumdisilicid zu Polysilanen.[16]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Calciumsilicid wird zur Herstellung von Pharmazeutika und für Desoxidationsmittel und Entschwefelungsmittel eingesetzt, die in der Herstellung von vielen Arten von Edelstahl verwendet werden können. Es wird auch als Impfstoff und Additiv in Gusseisen verwendet.[3] Sie kann auch zur Herstellung von Siloxenen verwendet werden, was schon von Wöhler entdeckt wurde.[17]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Calcium silicide, technical bei Sigma-Aldrich, abgerufen am 31. Oktober 2021 (PDF).
- ↑ a b K. H. Janzon, Herbert Schäfer, Armin Weiss: Notizen: Zur Struktur der Phase CaSi2. In: Zeitschrift für Naturforschung B. 23, 1968, doi:10.1515/znb-1968-1128.
- ↑ a b c d Datenblatt Calcium silicide, tech. Ca ≈30%, may contain up to 5 % Fe bei Alfa Aesar, abgerufen am 6. Juli 2017 (Seite nicht mehr abrufbar).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michelle J.S. Spencer, Tetsuya Morishita: Silicene Structure, Properties and Applications. Springer, 2016, ISBN 978-3-319-28344-9, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 2780 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Norbert Auner, Wolfgang A. Herrmann, Uwe Klingebiel: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 2, 1996 Volume 2: Groups 1,2, 13 and 14. Georg Thieme Verlag, 2014, ISBN 3-13-179171-3, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Egon Wiberg, Nils Wiberg: Inorganic Chemistry. Academic Press, 2001, ISBN 978-0-12-352651-9, S. 823 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. Böhm, O. Hassel: Die Kristallstruktur des Calciumsilicids CaSi2. In: Zeitschrift für anorganische und allgemeine Chemie. 160, 1927, S. 152, doi:10.1002/zaac.19271600115.
- ↑ Sarah M. Castillo, Zhongjia Tang, Alexander P. Litvinchuk, Arnold M. Guloy: Lattice Dynamics of the Rhombohedral Polymorphs of CaSi2. In: Inorganic Chemistry. 55, 2016, S. 10203, doi:10.1021/acs.inorgchem.6b01399.
- ↑ S. Fahy, D.R. Hamann: Electronic and structural properties of CaSi2. In: Physical Review, Serie 3. B - Condensed Matter , 41, 1990, S. 7587–7592, doi:10.1103/PhysRevB.41.7587.
- ↑ R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 358 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 376 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. Yu Tonkov: Compounds and Alloys Under High Pressure A Handbook. CRC Press, 1998, ISBN 978-90-5699-047-3, S. 100 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. Bordet, M. Affronte, S. Sanfilippo, M. Núñez-Regueiro, O. Laborde, G. L. Olcese, A. Palenzona, S. LeFloch, D. Levy, M. Hanfland: Structural phase transitions in under high pressure. In: Physical Review B. 62, 2000, S. 11392, doi:10.1103/PhysRevB.62.11392.
- ↑ J. J. Zuckerman, A. P. Hagen: Inorganic Reactions and Methods, The Formation of the Bond to Hydrogen. John Wiley & Sons, 2009, ISBN 0-470-14537-4, S. 77 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ulrich Schubert: Silicon Chemistry. Springer Science & Business Media, 2012, ISBN 978-3-7091-6357-3, S. 69 (eingeschränkte Vorschau in der Google-Buchsuche).



