Isotherme Zustandsänderung
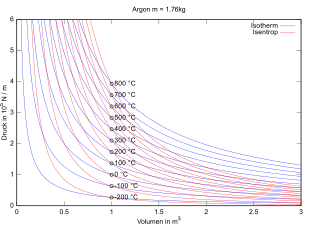
Die isotherme Zustandsänderung (oder isothermer Prozess) ist eine thermodynamische Zustandsänderung, bei der die Temperatur des betrachteten Systems unverändert bleibt. Die exakt isotherme Zustandsänderung ist ein theoretischer Idealfall, der in der Realität im Allgemeinen mithilfe eines Wärmebads nur näherungsweise erreicht werden kann. Beispiele für isotherme Prozesse sind isotherme Expansion oder Kompression, isotherme chemische Reaktionen (z. B. isotherme Verbrennung, Stoffwechsel von Lebewesen), isotherme Magnetisierung etc.
Isotherme Prozesse dienen oft als theoretische Modellprozesse zur Berechnung von Energieumsätzen bei Zustandsänderungen. Beispielsweise besteht der Carnotsche Kreisprozess, der den theoretischen Idealfall der Wärmekraftmaschine beschreibt, aus zwei isothermen Prozessen bei zwei verschiedenen Temperaturen und zwei adiabatischen Prozessen.
Nach dem Gesetz von Boyle-Mariotte gilt für die isotherme Zustandsänderung idealer Gase bei gleichbleibender Stoffmenge:
( Druck, Volumen, und Index für Anfang bzw. Ende der Zustandsänderung.)
Isotherme Volumenänderung beim idealen Gas[Bearbeiten | Quelltext bearbeiten]
Bei einer gegebenen Menge eines idealen Gases hängt die Innere Energie nur von der Temperatur ab, bleibt bei einem isothermen Prozess also konstant. Nach dem 1. Hauptsatz der Thermodynamik gilt daher für die Arbeit und die Wärme , die bei einer isothermen Volumenänderung anfallen,
- .
Ist der Druck im Gas und wird das Volumen von zu verändert, gilt für die Arbeit
Nach der Thermischen Zustandsgleichung für eine Gasmenge von Molen bei der Temperatur ändert sich der Druck dabei gemäß
Dabei ist die allgemeine Gaskonstante. Nach Einsetzen ergibt das Integral
- .
Die am Gas zu leistende Arbeit ist positiv bei Kompression , und negativ (d. h. das Gas leistet Arbeit) bei Expansion .[1] Für die Aufrechterhaltung konstanter Temperatur ist eine gleich große Wärme abzuführen (Kompressionswärme) bzw. – bei Expansion – zuzuführen. Somit ist die isotherme Expansion des idealen Gases ein Prozess, bei dem eine zugeführte Wärmemenge vollständig in Arbeit umgewandelt wird. Allerdings lässt sich dieser Prozess nicht einfach wiederholen, ohne dass das Gas durch erneuten Einsatz von zugeführter Arbeit und abgeführter Wärme wieder in seinen Ausgangszustand versetzt wird. Daher besteht kein Widerspruch zum 2. Hauptsatz der Thermodynamik.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Günter Cerbe, Gernot Wilhelms: Technische Thermodynamik: Theoretische Grundlagen und praktische Anwendungen. München 2021, ISBN 978-3-446-46519-0, S. 114–118



















