Nickel(II)-sulfid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
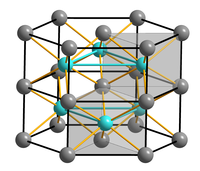
| ||||||||||
| __ Ni2+ __ S2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Nickel(II)-sulfid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NiS | |||||||||
| Kurzbeschreibung |
geruchloses schwarzes Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 90,76 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
5,66 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (4 mg·l−1)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Nickel(II)-sulfid ist das Nickel(II)-Salz der Schwefelwasserstoffsäure, also eine chemische Verbindung aus der Gruppe der Sulfide.
Vorkommen
Nickel(II)-sulfid kommt natürlich in Form des Minerals Millerit vor. Es kann auch in der Glasherstellung als unerwünschter Einschluss in Gläsern entstehen, die zu Brüchen führen können.[4]
Gewinnung und Darstellung
Nickel(II)-sulfid fällt aus ammoniakalischen, nicht jedoch aus sauren, nickelhaltigen Lösungen mit Ammoniumsulfid aus und dient so als Nachweisreaktion.
α-Nickel(II)-sulfid kann auch durch Reaktion von Nickel(II)-chlorid-hexahydrat in einer Ammoniumchloridlösung mit Schwefelwasserstoff unter Luftausschluß dargestellt werden.[5]
β-Nickel(II)-sulfid kann bei 900 °C aus den Elementen gewonnen werden.[5]
γ-Nickel(II)-sulfid kann aus Nickelsulfat und Schwefelwasserstoff dargestellt werden.[5]
Eigenschaften
γ-Nickel(II)-sulfid ist ein schwarzes Pulver. In verdünnter Salzsäure ist es schlecht löslich. Es hat eine trigonale Kristallstruktur vom Millerit-Typ mit der Raumgruppe R3m (Raumgruppen-Nr. 160), a = 961,2 pm, c = 325,9 pm, und es geht bei 396 °C in β-Nickel(II)-sulfid über. Dieses ist ein ebenfalls schwarzes Pulver, das in heißer Salzsäure löslich ist. Es hat eine hexagonale Kristallstruktur vom Nickelarsenid-Typ mit der Raumgruppe P63/mmc (Nr. 194), a = 343,9 pm, c = 534,8 pm. α-Nickel(II)-sulfid ist ein röntgenamorphes schwarzes Pulver, das in Salzsäure löslich ist. Es geht an der Luft in Ni(OH)S über.[5]
Verwendung
Verwendet wird Nickel(II)-sulfid als Mineral zur Nickelherstellung und als Katalysator.
Sicherheitshinweise
Wie viele Nickelverbindungen wird Nickelsulfid als krebserzeugend eingestuft.[1]
Siehe auch
- Trinickeldisulfid, Ni3S2 (CAS Nr: 12035-72-2)
- Nickeldisulfid, NiS2 (CAS Nr: 12035-51-7)
Einzelnachweise
- ↑ a b c d e f Eintrag zu Nickel(II)-sulfid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Eintrag zu Nickel sulphide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ VWR: Nickel sulfide, 99,9 % (metals basis)
- ↑ Spontanbruch von Einscheiben-Sicherheitsglas (ESG). In: Baulinks.de, 17. Juli 2003, abgerufen am 6. Dezember 2012.
- ↑ a b c d Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1693.





