Nierenkrebs
| Klassifikation nach ICD-10 | |
|---|---|
| C64 | Bösartige Neubildung der Niere, ausgenommen Nierenbecken |
| C65 | Bösartige Neubildung des Nierenbeckens |
| ICD-10 online (WHO-Version 2019) | |
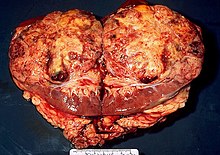
Nierenkrebs (bösartiger Nierentumor) ist relativ selten (1 bis 2 % aller bösartigen Tumoren). Am häufigsten ist das Nierenzellkarzinom (Synonyme: Hypernephrom (veraltet), Grawitz-Tumor), welches von den proximalen Tubuluszellen (Epithelzellen) ausgeht. Es betrifft etwa neun von 100.000 Einwohnern, wobei Männer dreimal häufiger erkranken als Frauen. Überwiegend tritt das Nierenzellkarzinom im fünften und sechsten Lebensjahrzehnt auf.
Risikofaktoren sind hohes Alter, Rauchen, chronische Niereninsuffizienz, langjährige Analgetikatherapie, Exposition zu Trichlorethen,[1] Cadmium- und Bleibelastung und angeborene Nierenerkrankungen (tuberöse Sklerose, Morbus Hippel-Lindau).
Klassifikation
Unter Nierenkrebs im engeren Sinne versteht man bösartige Erkrankungen, die dem Funktionsgewebe der Niere (Nierenparenchym) entspringen. Prinzipiell kann an allen Abschnitten eines Nephrons eine maligne Entartung entstehen.
Diese Arten von Nierentumoren werden auch als Nierenzellkarzinome (NCC) bezeichnet. Es wird nach dem Ausgangsgewebe, den zytogenetischen Befunden und dem histologischen Bild unterschieden. Am häufigsten findet sich das konventionelle Nierenzellkarzinom, das oft auch als klarzelliges bezeichnet wird. Weiterhin finden sich das chromophile (papilläre), das chromophobe und am seltensten das Ductus-Bellini-Karzinom (Sammelrohrkarzinom). Letzteres zeichnet sich durch besondere Aggressivität aus. Auch das Wachstumsmuster dieser Tumoren wird erwähnt. Tumorzytogenetisch werden chromosomale Aberrationen (Chromosomenabweichungen) beschrieben. Die Zellen des konventionellen Nierenzellkarzinoms zeigen beispielsweise früh im Entstehungsprozess einen Fragmentverlust am Chromosom 3.
Klassifikation der epithelialen Neoplasien in der Niere
|
Karzinomtyp |
Wachstumsmuster |
Ursprung |
Zytogenetik |
|---|---|---|---|
|
Klarzellkarzinom |
azinös, sarkomatoid |
proximaler Tubulus |
3p- |
|
papilläres Karzinom |
papillär, tubulär |
proximaler Tubulus |
+7, +17, -Y |
|
chromophobes Karzinom |
solid, tubulär, sarkomatoid |
Sammeltubulus (kortikal) |
|
|
onkozytäres Karzinom |
Tumornester |
Sammeltubulus (kortikal) |
- |
|
Ductus-Bellini-Karzinom |
papillär, sarkomatoid |
Sammeltubulus (medullär) |
- |
Im weiteren Sinne versteht man unter Nierenkrebs auch bösartige Erkrankungen, die zwar in der Niere entstehen, nicht jedoch dem Funktionsgewebe der Niere entspringen. Hervorzuheben ist das Nierenbeckenkarzinom (Urothelkarzinom des Nierenbeckens). Dies ist ein Tumor, der dem Übergangsgewebe (Urothel) in den angrenzenden Harnwegen entspringt. Von besonderer Wichtigkeit ist auch das Nephroblastom (Wilms-Tumor). Das ist ein embryonaler Mischtumor, welcher in der Pädiatrie eine bedeutende Rolle spielt. Weitere maligne Prozesse in der Niere können durch Metastasen (Lungenkrebs, Brustkrebs, malignes Melanom) und vereinzelt durch Sarkome verursacht sein.
Symptome

Die klassische Trias Blut im Harn (Hämaturie), Flankenschmerzen und tastbarer Tumor in der Flanke findet man nur noch selten. Wenn der Tumor in die linke Nierenvene einbricht, kann sich beim Mann eine symptomatische Varikozele im linken Hoden bilden (1 % der Fälle). Weiterhin treten selten paraneoplastische Syndrome auf (durch die Tumorzellen gebildete Hormone, etwa Renin, Erythropoetin, Parathormon oder ACTH). Wie bei den meisten Tumorerkrankungen können Allgemeinsymptome wie Müdigkeit, Fieber und Gewichtsverlust auftreten. 70 % der Nierentumoren werden zufällig im Rahmen von bildgebenden Untersuchungen (Sonographie, Computertomographie usw.) gefunden. Dies hat in den letzten zwei Jahrzehnten auch zu einem sogenannten „stage shift“ geführt: Es werden immer häufiger kleine nicht symptomatische Tumoren in den Nieren gefunden, die sich somit auch besser behandeln lassen.
Diagnose
Bei der klinischen Untersuchung fallen nur große, fortgeschrittene Tumoren im Bauch auf. Die Laboruntersuchung kann eine durch den Blutverlust über den Urin hervorgerufene Anämie zeigen. Die Sonographie ist der erste Schritt zur genaueren Beurteilung der Niere. Mit ihrer Hilfe können auch Punktionen verdächtiger Raumforderungen in der Niere vorgenommen werden, die dann vom Pathologen histologisch beurteilt werden. Eine i.v.-Urographie ist eine Röntgenaufnahme mit nierengängigem Kontrastmittel, die Aufschlüsse über einen behinderten Harnabfluss geben kann und die Funktion der gesunden Niere beurteilen lässt. Um die Ausbreitung des Tumors (Staging) und damit die Operabilität zu bestimmen, wird eine Computertomographie des Bauches durchgeführt. Mit Röntgenaufnahmen der Brust (Thorax) und ggf. einer Skelettszintigraphie und einer Gehirn-MRT (Kernspin) lassen sich mögliche Fernmetastasen nachweisen. Erwähnenswert ist, dass sich röntgenografisch Metastasen ab 1 cm Durchmesser erfassen lassen, was der Computertomographie eindeutig den Vorzug gibt.
| T1 | Tumor begrenzt auf die Niere und ≤ 7 cm |
| T1a | Tumor 4 cm oder weniger in größter Ausdehnung |
| T1b | Tumor mehr als 4 cm, aber nicht mehr als 7 cm in größter Ausdehnung |
| T2a | Tumor begrenzt auf die Niere und 7–10 cm |
| T2b | Tumor begrenzt auf die Niere aber >10 cm |
| T3 | Tumor infiltriert das umliegende Gewebe nicht über die Gerota-Faszie |
| T3a | Tumor infiltriert die Nebenniere oder das perirenales Gewebe |
| T3b | Tumor infiltriert die Nierenvene oder die Vena cava inferior bis unterhalb des Zwerchfells |
| T3c | Tumor infiltriert die Vena cava inferior oberhalb des Zwerchfells |
| T4 | Tumor infiltriert über die Gerota-Faszie hinaus |
| N0 | keine Lymphknotenmetastasen |
| N1 | Metastasen in einem Lymphknoten (< 2 cm) |
| N2 | Metastasen in mehr als einem Lymphknoten (> 2 cm bis 5 cm) |
| N3 | Metastasen in mehr als einem Lymphknoten (> 5 cm) |
| M0 | keine Fernmetastasen |
| M1 | Fernmetastasen |
Therapie
Chirurgische Therapie
Die Therapie der Wahl bei Vorliegen eines nicht metastasierten Nierenzellkarzinoms ist die chirurgische Entfernung des Tumors, wobei neuere Studien gezeigt haben, dass die onkologischen Langzeitergebnisse bei nierenerhaltender Entfernung des Nierentumors (wenn operativ möglich und sinnvoll) genauso gut sind wie die radikale Entfernung der Niere.[2]
Bei größeren Tumoren (Stadium T2 bis T4) wird die ganze Niere mit Nebenniere, Harnleiter und dem sie umgebenden Fettgewebe und Kapsel chirurgisch entfernt. In die Nierenvene und Vena cava inferior gewachsene Tumorzapfen müssen mitreseziert werden, ggf. mit Einsatz einer Herz-Lungen-Maschine bei Vorwachsen bis in den rechten Herzvorhof. Auch andere Standards sind durch neueste Erkenntnisse in Diskussion: Einzug der laparoskopischen radikalen Nephrektomie und nierenerhaltenden Teilresektion; ist die Nebennierenentfernung immer notwendig?; nierenerhaltende Chirurgie auch bei zwei gesunden Nieren, minimal-invasive Therapiealternativen (RITA – Radiofrequency interstitial tumor ablation, HIFU – High-intensity focused ultrasound usw.).
Medikamentöse Therapie
| Medikament | Substanzklasse | Einsatzgebiet |
|---|---|---|
| Interferon alpha | Zytokin | Erst- und Zweitlinientherapie heute in der Regel nur noch nachgeordnet verwendet |
| Sunitinib | Tyrosinkinase- Inhibitor (TKI) |
Erstlinientherapie bei Niedrig-Risiko |
| Pazopanib | TKI | Erst- und Zweitlinientherapie bei Niedrig-Risiko |
| Everolimus | mTOR-Inhibitor | Erstlinientherapie bei Hochrisiko |
| Bevacizumab | monoklonaler Antikörper |
Erstlinientherapie bei Niedrigrisiko |
| Axitinib | TKI | Zweitlinientherapie bei Niedrig-Risiko |
| Sorafenib | TKI | Zweitlinientherapie bei Niedrig-Risiko |
| Interleukin-2 | Zytokin | Erst- und Zweitlinientherapie, nur in sehr ausgewählten Situationen |
Medikamentöse Therapien kommen zum Einsatz beim lokal inoperablen oder metastasierten Nierenzellkarzinom. Die Therapie ist dann palliativ, eine Heilung kann nur in sehr seltenen Ausnahmefällen erreicht werden. Bisher konnte auch kein Vorteil einer adjuvanten medikamentösen Therapie (d. h. unterstützend, nach erfolgter Operation) nachgewiesen werden. In ausgewählten Einzelfällen kann es Sinn haben, eine neoadjuvante medikamentöse Therapie durchzuführen um eine Operabilität zu erreichen. Therapiestandard ist das jedoch nicht.[3]
In den letzten Jahren hat sich ein erheblicher Wandel ergeben und eine ganze Reihe von neuartigen Substanzen sind zur Behandlung zugelassen worden. Viele davon haben in den randomisiert-kontrollierten Studien für die Europäische Zulassung in der Regel zwar eine statistisch signifikante Verlängerung des progressionsfreien Überlebens gezeigt, nur in einzelnen Fällen hat sich dies aber auch in eine statistisch signifikante Verlängerung des Gesamtüberlebens übersetzt (was zum Teil auch im Studiendesign begründet war[4]). Kuratives Potential, etwa in Form lang anhaltender kompletter Remissionen von Metastasen, wie sie unter Hochdosis-Immuntherapie bei wenigen geeigneten Patienten berichtet wurden,[5] hat sich für diese neuen Wirkstoffe bislang noch nicht bestätigt.[6][7] Weitere Substanzen aus der Gruppe der Tyrosinkinase-Inhibitoren sind zurzeit in der klinischen Prüfung (Cediranib).
Herkömmliche Zytostatika
Die klassischen Substanzklassen der Zytostatika (Anthracycline, Antimetaboliten, Alkylanzien, Mitosehemmer, Nukleosidanaloga) sind beim Nierenzellkarzinom weitgehend unwirksam. Das Nierenzellkarzinom gilt deswegen als chemotherapieresistentes Karzinom. Die Einzelsubstanzen mit der größten Wirksamkeit sind Vinblastin und 5-Fluorouracil mit jeweils etwa 7 % Ansprechen.[8]
Immuntherapie
Eine Krebsimmuntherapie kann entweder unspezifisch (durch Stimulation des Immunsystems in der Hoffnung, dadurch eine anti-Tumor-Aktivität hervorzurufen) oder spezifisch, d. h. beispielsweise durch Tumor-Vakzinen erfolgen. Bezüglich der unspezifischen Immuntherapien gibt es seit den 1980er Jahren Therapieversuche mit Interferon alpha (IFNα) und/oder Interleukin-2 (IL-2). IFNα führt zu Ansprechraten von 8 bis 29 % und zu einem um etwa 5 Monate verlängerten Gesamtüberleben, im Vergleich zu unbehandelten Patienten. Heute gilt IFNα als Medikament der zweiten Wahl, da neuere Substanzen wirksamer sind. Die Therapieergebnisse mit IL-2 sind uneinheitlich, wobei diese Therapie erhebliche Nebenwirkungen hat.[9]
Eine im Herbst 2007 veröffentlichte Übersichtsarbeit[10] beschreibt die adjuvante Verabreichung eines autologen Tumorvakzins. Der aus den körpereigenen Tumorzellen des Patienten gewonnene Impfstoff Reniale hat in Phase-III-Studien die Zeitspanne des progressionsfreien Überlebens und des Gesamtüberlebens der Nierenkrebspatienten verbessert.[11]
Orale Tyrosinkinase-Inhibitoren, Bevacizumab
Die vertieften molekularen Kenntnisse über die Entstehung des Nierenzellkarzinoms haben deutlich gemacht, dass bestimmte sogenannte Signaltransduktionswege in den Tumorzellen eine wichtige Rolle spielen. Dazu gehören Signalwege, bei denen die Tyrosinkinasen VEGFR, PDFGRA/B, FGFR1 etc., eine Rolle spielen. In Therapiestudien hat sich gezeigt, dass entsprechende, mehr oder weniger spezifische Tyrosinkinase-Inhibitoren das Tumorwachstum verlangsamen und zum Teil auch die Überlebenszeit verlängern können. In Deutschland sind für das Nierenzellkarzinom mit niedrigem bzw. intermediären Risiko nach der MSKCC-Klassifikation zurzeit (Stand: Dezember 2014) zwei Substanzen aus dieser Medikamentenklasse zugelassen: Sunitinib und Pazopanib. Die Wirksamkeit der beiden Substanzen scheint vergleichbar und das mediane Überleben lag bei beiden Medikamenten in einer großen Vergleichsstudie bei etwa 28 Monaten.[12] Für die second line Therapie (also nach dem Versagen einer vorangegangenen medikamentösen Therapie) sind die Tyrosinkinase-Inhibitoren Sorafenib, Axitinib und Pazopanib (natürlich nur wenn dieses vorher nicht gegeben wurde) zugelassen. Ein weiteres Medikament, das auf den Tyrosinkinasen-Signalweg abzielt ist Bevacizumab, ein monoklonaler Antikörper, der gegen das Zytokin VEGF gerichtet ist. Auch Bevacizumab ist für die Erstlinientherapie beim Niedrigrisiko-Nierenzellkarzinom zugelassen (Stand: Dezember 2014). Alle drei Medikamente führen zu einer Verzögerung des Krankheitsfortschritts um zum Teil etliche Monate, allerdings weniger als einem Jahr.[3]
mTOR-Inhibitoren
Everolimus ist ein sogenannter mTOR („mammalian target of rapamycin“) -Inhibitor und zeigte Wirksamkeit bei Patienten mit Hochrisiko-Nierenzellkarzinom (nach der MSKCC-Klassifikation). Hierfür besitzt das Medikament auch eine Zulassung in der Erstlinie. Auch hier betrug die Verzögerung des Krankheitsfortschritts („progressionsfreies Überleben“) einige Monate.
Prognose
Die 5-Jahres-Überlebensrate des Nierenzellkarzinoms beträgt insgesamt etwa 50 %.
Stadienabhängig:
- lokal begrenzt (T1-T2, N0, M0): 70–80 %
- lokal fortgeschritten (T3, N0-N2, M0): 20–60 %
- Fernmetastasen (alle T, alle N, M1): <10 %
Literatur
- S3-Leitlinie Nierenzellkarzinom, Diagnostik, Therapie und Nachsorge der Deutschen Gesellschaft für Urologie (DGU) und der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO). In: AWMF online (Stand 2015)
Weblinks
- Nierenzellkrebs: Bösartige Erkrankungen der Niere, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 29. Januar 2013. Zuletzt abgerufen am 4. September 2014.
- www.urologielehrbuch.de – Ausführliches Kapitel über das Nierenzellkarzinom aus dem Online Urologie-Lehrbuch für Ärzte und medizinisches Fachpersonal
- www.meb.uni-bonn.de/cancernet – Bei Kindern tritt der Nierenkrebs eher als Wilms’ Tumor auf. Link zur Abhandlung darüber.
- Zusammenfassung der Studienergebnisse (Universität Wien)
Einzelnachweise
- ↑ Eintrag zu Trichlorethylen in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Frank Becker et al.: Wichtige Aspekte der organerhaltenden Nierentumorchirurgie: Indikationsstellungen, neuer Standard und onkologische Ergebnisse. In: Dtsch Arztebl Int. Nr. 106(8), 2009, S. 117–122 (Artikel). PDF
- ↑ a b c M. A. Reiter, M. Kurosch, A. Haferkamp: Nierenzellkarzinom – Medikamentöse Therapie und prognostische Modelle. In: Onkologe. 2014; 20, S. 1241–1254. doi:10.1007/s00761-014-2784-1
- ↑ So war z. B. bei vielen Zulassungsstudien ein cross-over zwischen den Therapiearmen möglich.
- ↑ D. F. McDermott: Immunotherapy of metastatic renal cell carcinoma In: Cancer. 2009, 115, S. 2298–2305.
- ↑ C. Coppin, C. Kollmannsberger, L. Le, F. Porzolt, T. J. Wilt: Targeted therapy for advanced renal cell cancer (RCC): a Cochrane systematic review of published randomised trials In: BJU Int. 2011, 108, S. 1556–1563.
- ↑ P. Ivanyi u. a.: Neue Therapien beim fortgeschrittenen Nierenzellkarzinom. In: Dtsch Arztebl. Nr. 105(13), 2008, S. 232–237 (Artikel).
- ↑ W. M. Stadler, D. Huo, C. George, X. Yang, C. W. Ryan, T. Karrison, T. M. Zimmerman, N. J. Vogelzang: Prognostic factors for survival with gemcitabine plus 5-fluorouracil based regimens for metastatic renal cancer. In: J Urol. 2003;170(4 Pt 1), S. 1141–1145. PMID 14501711.
- ↑ D. F. McDermott: Immunotherapy and targeted therapy combinations in renal cancer. In: Current clinical pharmacology. Band 6, Nummer 3, August 2011, ISSN 2212-3938, S. 207–213, PMID 21827391 (Review).
- ↑ C. Doehn, A. S. Merseburger, D. Jocham, M. A. Kuczyk: Gibt es eine Indikation zur neoadjuvanten oder adjuvanten Systemtherapie beim Nierenzellkarzinom? In: Der Urologe. Volume 46, Number 10 / Oktober 2007 doi:10.1007/s00120-007-1540-1
- ↑ May M et al.: Ten-year survival analysis for renal carcinoma patients treated with an autologous tumour lysate vaccine in an adjuvant setting. Cancer Immunol Immunother. 2010 May;59(5):687-95 PMID 19876628
- ↑ R. J. Motzer, T. E. Hutson, D. Cella, J. Reeves, R. Hawkins, J. Guo, P. Nathan, M. Staehler, P. de Souza, J. R. Merchan, E. Boleti, K. Fife, J. Jin, R. Jones, H. Uemura, U. De Giorgi, U. Harmenberg, J. Wang, C. N. Sternberg, K. Deen, L. McCann, M. D. Hackshaw, R. Crescenzo, L. N. Pandite, T. K. Choueiri: Pazopanib versus sunitinib in metastatic renal-cell carcinoma. In: N Engl J Med. 2013;369(8), S. 722–731. doi:10.1056/NEJMoa1303989 PMID 23964934.