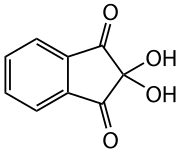
Ninhydrin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Ninhydrin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C9H6O4 | |||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 178,15 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
schlecht in Wasser (20 g·l−1 bei 20 °C)[2]
| |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Ninhydrin ist das Hydrat des Indan-1,2,3-trions und dient als Reagenz zum Nachweis von Ammoniak und primären Aminogruppen, insbesondere von Aminosäuren.
Eigenschaften
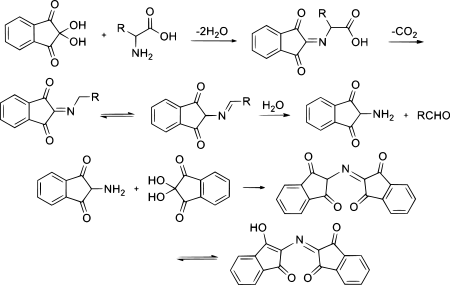
Ninhydrin reagiert mit der Aminogruppe von Aminosäuren unter Wasserabspaltung zu einer Schiffschen Base (Imin). Nach Decarboxylierung der Carboxygruppe der Aminosäure und anschließender Abspaltung des Amino-Restes entsteht Amino-Ninhydrin. Dieses dimerisiert mit Ninhydrin zu einem violetten Farbstoff (Ruhemanns Purpur). Die intensive violette Farbe kann durch Mesomerie unter der Beteiligung einer Wasserstoffbrückenbindung innerhalb des Systems konjugierter Doppelbindungen erklärt werden.[4]
Die Intensität der Farbe ist der Konzentration des Farbstoffes (siehe Lambert-Beersches Gesetz) und damit der Konzentration einer zu bestimmenden Aminosäure proportional. Zur quantitativen Analyse werden photometrisch bei 570 nm mehrere Proben mit bekannter Konzentration als Standards mit der zu untersuchenden Probe verglichen. Bei der Reaktion mit sekundären Aminosäuren, wie Prolin oder Hydroxyprolin, entsteht ein gelber Farbkomplex, welcher bei 400 nm photometrisch gemessen werden kann.
Ninhydrin hat auch eine Bedeutung bei der Umsatzkontrolle bei der Festphasen-Peptidsynthese (SPPS) und in der organischen Festphasensynthese (SPOS) und ist ein Bestandteil des Kaiser-Tests.[5][6]
Die Reaktion ist relativ empfindlich, die Nachweisgrenze liegt bei 0,001 bis 0,1 mg.
Verwendung
Ninhydrin wird vor allem für den Nachweis von Aminosäuren und Proteinen verwendet. Für Proteine ist der Test jedoch nur erfolgreich, wenn relativ kurze Oligopeptide vorliegen, da Ninhydrin nur mit freien Aminogruppen reagiert und diese bei langkettigen Polypeptiden kaum vorhanden sind. Der Nachweis wird in Lösung (unter Erhitzen im Wasserbad) durchgeführt. Ninhydrin wird häufig auch als Sprühreagenz z. B. bei der Papierchromatografie oder Dünnschichtchromatographie verwendet.
Eine weitere auf dieser Reaktion basierende Anwendung ist die Erstellung von Fingerabdrücken. Da im Schweiß Aminosäuren vorkommen, können diese mit Ninhydrin reagieren und die Finger- bzw. Handabdrücke sichtbar machen.
Dieser Mechanismus findet auch in der Medizin als sogenannter Moberg-Test Anwendung zum Nachweis peripherer Nervenläsionen. Da die für die Schweißsekretion regulierenden sympathischen Fasern ab dem Austritt aus dem Rückenmark gemeinsam mit den peripheren Nervenbahnen verlaufen, ist auch die Schweißsekretion gestört, was sich an einem abgenommenen Hautabdruck mittels Ninhydrin nachweisen lässt.
Eine Ausnahme bildet die Aminosäure Prolin bzw. Hydroxyprolin, die als sekundäre Aminosäuren statt einer primären (NH2) eine sekundäre (NH) Aminogruppe besitzen. Prolin und Hydroxyprolin reagieren über einen anderen Reaktionsmechanismus zu einem gelbroten Produkt mit einem Absorptionsmaximum bei 440 nm.

Reaktionsmechanismus
Der Reaktionsmechanismus ist komplizierter als üblicherweise dargestellt; damit befassen sich Friedmann und Williams.[7] Im Einzelnen laufen -wie in der Darstellung zu sehen- folgende Reaktionen ab: Zunächst wird das Ninhydrin zum Trion dehydratisiert. Am mittleren Carbonylsauerstoff greift die Aminogruppe der Aminosäure an und kondensiert zum Imin. Dieses weist eine offene Siebenring-Struktur auf, welche eine zyklische Elektronenverschiebung unter Decarboxylierung ermöglicht. Durch Hydrolyse des Imins wird der Aminosäurerest als Aldehyd abgespalten und es verbleibt das primäre Amin. In einer Kondensationsreaktion entsteht so mit einem zweiten Ninhydrinmolekül unter Wasserabspaltung das Ruhemanns Purpur.
Besonderheiten
Ninhydrin ist eine der wenigen Verbindungen, die der Erlenmeyerregel widersprechen.
Einzelnachweise
- ↑ a b Eintrag zu Ninhydrin. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c Eintrag zu Ninhydrin in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ a b Datenblatt Ninhydrin bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 465, ISBN 3-13-672201-9.
- ↑ E. Kaiser, R.L. Colescott, C.D. Bossinger, P.I. Cook: In Analytical Biochemistry 1970, 34, 595–598.
- ↑ V. K. Sarin, S. B. H. Kent, J. P. Tam, R. B. Merrifield: In Analytical Biochemistry 1981, 117, 147.
- ↑ Mendel Friedman, L. David Williams: Stoichiometry of formation of Ruhemann's purple in the ninhydrin reaction. In: Bioorganic Chemistry. Band 3, Nr. 3, 1974, S. 267–280, doi:10.1016/0045-2068(74)90017-0.
Literatur
- Siegfried Ruhemann (1910): Cyclic di- and tri-ketones. In: Journal of the Chemical Society Transactions. 97, S. 1438–1449. doi:10.1039/CT9109701438
Weblinks
- Ruhemanns Purpur ( vom 31. Mai 2008 im Internet Archive)
- Nachweis von Aminosäuren in Milch
- Reaktionsmechanismus