3,9-Diethyliden-2,4,8,10-tetraoxaspiro(5.5)undecan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan | |||||||||||||||
| Andere Namen |
DETOSU | |||||||||||||||
| Summenformel | C11H16O4 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 212,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
wasserunlöslich[4], löslich in Pentan,[4][2] in n-Hexan[1], in Heptan[2], in Tetrahydrofuran[1][5] und 1,4-Dioxan[5][6] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan, kurz DETOSU, ist ein bicyclisches Ketenacetal, das sich vom isomeren Allylacetal 3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan, kurz DVTOSU, ableitet. DETOSU ist als bifunktionelles Monomer ein wichtiger Baustein für Polyorthoester, die durch Addition von Diolen an die aktivierte Doppelbindung des Diketenacetals entstehen.[8]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Umlagerung des DVTOSU in das DETOSU ist eine exotherme Reaktion, die auch spontan mit vollständigem Umsatz abläuft.[9] Zur Herstellung im technischen Maßstab wird DVTOSU bei erhöhten Temperaturen in Gegenwart von Katalysatoren umgelagert.
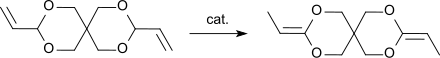
Neben der Durchführung der Umlagerungsreaktion in alkalischem Medium, wie z. B. mit n-Butyllithium in Ethylendiamin[1] oder Kalium-tert-butanolat in Ethylendiamin[4] kann die Reaktion auch photochemisch durch UV-Bestrahlung in Gegenwart von Eisenpentacarbonyl als Katalysator und Triethylamin in siedendem Pentan[2] oder mit Tris(triphenylphosphin)ruthenium(II)dichlorid – Natriumcarbonat in Substanz durchgeführt werden.[3][10]
Um für den Einsatz als Monomer brauchbare Reinheiten zu erhalten, muss das nach der Umlagerungsreaktion und Vakuumdestillation erhaltene Rohprodukt mehrfach aus Pentan umkristallisiert werden. Die Ausbeuten an Reinprodukt liegen bei ca. 50 % d.Th.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan ist im Reinzustand ein bei Raumtemperatur kristallines Material.[1] Wegen seiner geringen Kristallisationsneigung wird es zumeist als Flüssigkeit eingesetzt. DETOSU ist relativ instabil. Es hydrolysiert bereits in Gegenwart von Wasserspuren schnell und isomerisiert spontan während der Lagerung zum für die Polyreaktion inaktiven Diallylacetal DVTOSU.[11] Die Reinsubstanz ist sehr reaktiv gegenüber dem Angriff elektrophiler Agentien und neigt stark zur kationischen Polymerisation.[3] Charakteristisch für DETOSU ist die intensive IR-Bande bei 1700 cm−1, anhand derer auch der Umsatz bei der Umlagerungsreaktion verfolgt werden kann.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Das Diketenacetal 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan, DETOSU, ist ein reaktives bifunktionelles Monomer, das durch Polyaddition mit α,ω-Diolen bioabbaubare Polyorthoester bildet.

Polyorthoester finden Verwendung als Einbettungsmedien für Pharmaka in Depotarzneiformen zur kontrollierten Wirkstofffreisetzung durch Oberflächenerosion unter physiologischen Bedingungen.[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Patent US5939453: PEG-POE, PEG-POE-PEG, and POE-PEG-POE block copolymers. Veröffentlicht am 17. August 1999, Anmelder: Advanced Polymer Systems, Inc., Erfinder: J. Heller, S.Y. Ng.
- ↑ a b c d Patent US6863782: Method of preparing di(ketene acetals). Veröffentlicht am 8. März 2005, Anmelder: A.P. Pharma, Inc., Erfinder: P.W. Newsome et al..
- ↑ a b c J. V. Crivello, R. Malik, Y.-L. Lai,: Ketene acetal monomers: Synthesis and characterization. In: J. Polym. Sci. A Polym. Chem. Band 34, 1996, S. 3091–3102, doi:10.1002/(SICI)1099-0518(19961115)34:15<3091::AID-POLA1>3.0.CO;2-0.
- ↑ a b c Patent US4532335: Preparation of ketene acetals by rearrangement of allyl and substituted allyl acetals. Veröffentlicht am 30. Juli 1985, Anmelder: SRI International, Erfinder: R.F. Helwing.
- ↑ a b K. Bouchemal, S. Briancon, P. Chaumont, H. Fessi, N. Zydowicz: Microencapsulation of dehydroepiandrosterone (DHEA) with poly(ortho ester) polymers by interfacial polycondensation. In: J. Microencapsulation. Band 20, Nr. 5, 2003, S. 637–651, doi:10.1080/0265204031000148040.
- ↑ Patent US4549010: Bioerodible poly(ortho ester) thermoplastic elastomer from diketenen diacetal. Angemeldet am 27. Juni 1984, veröffentlicht am 22. Oktober 1985, Anmelder: Merck & Co., Inc., Erfinder: R.V. Sparer, S.A. Pogany.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. Heller, K. J. Himmelstein: Poly (ortho ester) biodegradable polymer systems. In: Methods in enzymology. Band 112, 1985, S. 422–436.
- ↑ E. Piskin: Biodegradable Polymers in Medicine. In: G. Scott (Hrsg.): Degradable Polymers: Principles and Applications. 2. Auflage. Kluwer Academic Press, 2002, ISBN 1-4020-0790-6.
- ↑ J. Heller: Poly(Ortho Esters). In: A. Lendlein, A. Sisson (Hrsg.): Handbook of Biodegradable Polymers: Synthesis, Characterization and Applications. Wiley-VCH, 2011, ISBN 978-3-527-32441-5.
- ↑ J. Heller: Poly (ortho esters). In: Robert S. Langer, Nicholas A. Peppas (Hrsg.): Biopolymers I. Advances in Polymer Science. Springer, Berlin / Heidelberg 1993, ISBN 3-540-56148-X, S. 41–92.
- ↑ J. Heller: Development of poly(ortho esters): a historical overview. In: Biomaterials. Band 11, Nr. 9, S. 659–665, doi:10.1016/0142-9612(90)90024-K.