N-Nitrosamide
| Grundkörper mit blau markierter funktioneller Gruppe |
N-Nitrosamid-Derivate mit blau markierter funktioneller Gruppe |
 N-Nitrosamide |
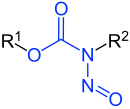 |
| R1 bis R3 sind Wasserstoffatome oder organische Reste | |
Nitrosamide, auch N-Nitrosamide, gehören wie die N-Nitrosamine zur Gruppe der Nitrosoverbindungen.[1] Im Fall der Nitrosamide handelt es sich um chemisch reaktive und im Metabolismus instabile nitrosierte Harnstoffe, Guanidine oder Carbamate.[1] Es handelt sich im Allgemeinen um Karzinogene. In der Diskussion um Verunreinigungen, die aus der Umwelt resultieren, nehmen die N-Nitrosamide im Gegensatz zu den N-Nitrosaminen keinen Stellenwert ein.[1]
Nutzen
Einen medizinischen Nutzen im Bereich der Bekämpfung maligner Tumore haben diverse Chlorethylnitrosoharnstoffe, wie der N,N′-bis(2-Chlorethyl)-nitrosoharnstoff (BCNU), erlangt.[2] Vermutungen zur Wirksamkeit gegen Krebszellen basieren auf der Alkylierbarkeit von Guanin-Cytosin-Zentren in den Sequenzen des Erbguts, spezieller den Onkogenen.[2]
Synthese
N-Nitrosamide lassen sich ausgehend von der Reaktion von N-monosubstituierten Säureamiden und dem, in Anwesenheit starker Säuren aus der salpetrigen Säure hervorgehenden, Nitrosylkation herstellen, hier beispielhaft anhand des N-Methylacetamids (1).[3][4] Vom Säureamid erfolgt dabei ein nukleophiler Angriff auf das Nitrosylkation. Aus dem entstehenden Kation bildet sich nach der Abspaltung eines Protons ein N-Nitrosamid (2):

Toxizität
Die Erbgut-schädigende Wirkung der N-Nitrosoverbindungen lässt sich auf die Entstehung reaktiver elektrophiler Teilchen im Metabolismus zurückführen.[5] Durch den spontanen Zerfall von N-Nitrosoharnstoffen im wässrigen Medium des Metabolismus, hier am Beispiel des 1-Methylnitrosoharnstoffs (3), bilden sich Diazonium-, beziehungsweise Carbeniumionen.[5] Der Zerfall erfolgt in Isocyansäure und Methyldiazohydroxid. Durch die Umlagerung zum Diazoniumion und die anschließende Abspaltung von Stickstoff entsteht ein Carbeniumion (4), welches nukleophile Schnittpunkte der DNA alkylieren kann.[5]

Im Organismus kann der Zerfall von N-Nitrosoharnstoffen mit höherem Substitutionsgrad ablaufen.[5] Eine alternative Entstehungsmöglichkeit von Diazonium- und Carbeniumionen ist durch die enzymatische Reaktion von Nitrosaminen gegeben.[5]
Typische Begleiterscheinungen im Rahmen medizinischer Krebsbehandlung mittels N-Nitrosoharnstoffen sind die Beeinträchtigung des Knochenmarks (Schädigung des Stammzellkompartiments), des lymphatischen Gewebes und des Magen-Darm-Trakts.[5]
Einzelnachweise
- ↑ a b c Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2, S. 747.
- ↑ a b Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2, S. 752–753.
- ↑ Adalbert Wollrab: Organische Chemie. Eine Einführung für Lehramts- und Nebenfachstudenten. 4. Auflage, Springer-Verlag Berlin Heidelberg 2014, ISBN 978-3-642-45144-7, S. 898.
- ↑ Heinz G. O. Becker, Rainer Beckert, Werner Berger, Günter Domschke, Egon Fanghänel, Mechthild Fischer, Frithjof Gentz, Karl Gewald, Reiner Gluch, Wolf D. Habicher, Hans-Joachim Knölker, Roland Mayer, Peter Meth, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. 24. Auflage, Wiley-VCH Verlag GmbH & Co.KGaA, Weinheim 2015, ISBN 978-3-527-33968-6, S. 648.
- ↑ a b c d e f Hans Marquardt, Siegfried G. Schäfer (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004, ISBN 3-8047-1777-2, S. 753–758.

