Regitz-Diazotransfer
Der Regitz-Diazotransfer ist eine Namensreaktion in der organischen Chemie, bei der von einem Diazo-Donor baseninduziert eine Diazogruppe auf eine CH-azide Verbindung übertragen wird. Publiziert wurde eine solche Reaktion 1910 erstmals von Otto Dimroth.[1] Namensgeber ist jedoch Manfred Regitz, der in den 60er-Jahren die bis dahin wenig beachtete Reaktion aufgriff und die generelle Möglichkeit der Umsetzung von Dicarbonylverbindungen auf beschriebenem Wege zeigte.[2] Der übliche und aufwendigere Weg der Diazotierung kann so also umgangen werden, zumal dieser nicht immer zum gewünschten Produkt führt.
Mechanismus des Regitz-Diazotransfers
Dimroth entdeckte den Mechanismus des Regitz-Diazotransfers, indem er Malonamid mithilfe von Phenylazid in Natriumethanolat umsetzte. Der Mechanismus wird im Folgenden allgemeiner am Beispiel eines 1,3-Dicarbonyls 1 erklärt: nach Zugabe einer Base wie z. B. Triethylamin (2) wird das Dicarbonyl zunächst in α-Position deprotoniert, es bildet sich das entsprechende Enolat 3. Aufgrund seines nukleophilen Charakters greift das Enolat dann den Diazo-Donor an, hier Tosylazid (4).

Im Übergangszustand I abstrahiert der am Schwefel des Tosylats gebundene Stickstoff des Azids dann das zweite azide Proton am Kohlenstoff. Die am Kohlenstoff entstehende negative Ladung (II) sorgt anschließend dafür, dass Tosylamid (6) als Abgangsgruppe abgespalten wird, es verbleibt die Diazogruppe am Kohlenstoff. Das Produkt ist also ein 2-Diazo-1,3-Dicarbonyl (5).
Anwendung
Vorteile liefert der Regitz-Diazotransfer vor allem durch die Möglichkeit, milde Basen wie Triethylamin, Diethylamin oder Piperidin einzusetzen, sowie die Umsetzbarkeit von cyclischen wie auch acyclischen 1,3-Dicarbonylen.[3] Einfache cyclische wie auch acyclische α-Carbonylverbindungen reagieren in der Regel nicht direkt mit Diazo-Donoren und sollten deshalb z. B. über eine zur Claisen-Kondensation analoge Formylierung aktiviert werden. Höhere Ausbeuten, besonders bei basensensitiven Verbindungen, erhält man durch Trifluoroacetylierung:[4]
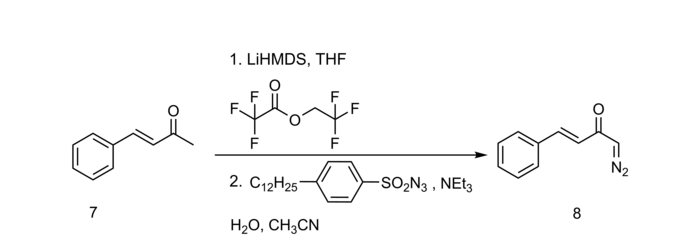
Die aus dem Diazotransfer entstehenden Produkte sind wichtige Intermediate für eine Vielzahl von Reaktionen, so für die Wolff-Umlagerung, spezieller auch die Arndt-Eistert-Homologisierung, sowie für übergangsmetall-katalysierte CH-, NH- und OH-Insertionen oder Cyclopropanierungen.
Einzelnachweise
- ↑ Dimroth, O., et al. Intramolecular Rearrangements. IV. Hydroxytriazoles and Diazocarboxylic Acid Amides. Ann. 1910, 373, 336–370, doi:10.1002/jlac.19103730306
- ↑ Regitz, M. Reaction of active methylene compounds with azides. I. New synthesis of α-diazo-β-dicarbonyl compounds from benzenesulfonyl azides and β-diketones. Ann. 1964, 676, 101–109, doi:10.1002/jlac.19646760112
- ↑ László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Science & Technology, Amsterdam, 2004, S. 376, ISBN 0124297854.
- ↑ Rick L. Danheiser, Raymond F. Miller, and Ronald G. Brisbois: Detrifluoroacetylative Diazo Group Transfer: (E)-1-Diazo-4-Phenyl-3-Buten-2-One In: Organic Syntheses. 73, 1996, S. 134, doi:10.15227/orgsyn.073.0134; Coll. Vol. 9, 1998, S. 197 (PDF).