MDAN-21
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
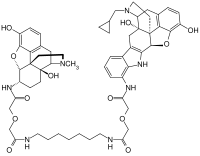
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | MDAN-21 | ||||||||||||
| Andere Namen |
7'-{2-[(6-{2-[({(5a,6a)-4,5-Epoxy-3,14-dihydroxy-17-methylmorphin-6-yl}-aminocarbonyl)methoxy]acetylamino}-heptylaminocarbonyl)-methoxy]-acetylamino}naltrindol (IUPAC) | ||||||||||||
| Summenformel | C58H71N7O12 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 1058,22 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
MDAN-21 ist ein Opioid mit zwei Pharmakophoren und schmerzstillenden Eigenschaften.
Eigenschaften
Die Struktur von MDAN-21 wurde im Zusammenhang mit Untersuchungen zu den biochemischen Mechanismen der Toleranz- und Suchtentwicklung bei chronischer Gabe von Opioiden entwickelt. MDAN-21 und ähnliche Substanzen dienen bisher in der experimentellen Pharmakologie zur Untersuchung solcher biochemischer Mechanismen.
MDAN-21 enthält die chemischen Strukturen zweier verschiedener Wirkstoffmoleküle: die eine, vom Naltrindol abgeleitete Struktur verändert dabei das Wirkungs-Nebenwirkungs-Profil der weiteren, vom Oxymorphon abgeleiteten Oxymorphamin-Struktur. Oxymorphamin ist das eigentlich wirksame Strukturelement von MDAN-21.
Struktur
MDAN-21 ist ein hetero-bivalenter Opioidrezeptor-Ligand, der aus einem µ-Agonist (α-Oxymorphamin) und einem δ-Antagonist (7'-Aminonaltrindol) besteht. Beide Pharmakophore sind über einen flexiblen Abstandshalter miteinander verbunden. Die Länge des Abstandshalters beeinflusst entscheidend die Wirkung und die Nebenwirkungen. MDAN-21 ist als Analgetikum bis zu 50 mal potenter als Morphin, kann bei Affen mit der 133-fachen Wirksamkeit effektiv ein Opioidentzugssyndrom unterdrücken, führt aber nicht zur Selbstverabreichung und bei chronischer Gabe im Vergleich mit Morphin nicht zu körperlicher Abhängigkeit. Die Substanz wird deshalb für die Entzugsbehandlung bei Opioidabhängigkeit untersucht.[2][3][4]
Bei MDAN-21 wurde ein vom Oxymorphon abgeleitetes µ-Agonist-Pharmakophor (α-Oxymorphamin) über einen 21-atomigen Spacer (25,4Ä) an ein vom Naltrindol abgeleitetes δ-Antagonist-Pharmakophor (7'-Aminonaltrindol) gebunden. Die Länge dieses Spacers erwies sich dabei als optimal, um bei Aufrechterhaltung der analgetischen Wirkung die Entwicklung von Toleranz und körperlicher Abhängigkeit am effektivsten zurückzudrängen. In ersten Tests an Mäusen erwies sich MDAN-21 bis zu 50 mal potenter als Morphin und führte weder zur Selbstverabreichung noch zur Entwicklung körperlicher Abhängigkeit.[2][4] Bei späteren Versuchen an 3 Affen konnte eine effektive analgetische Wirkung indes nur in einem Fall nachgewiesen werden.[3] MDAN-21 unterdrückte bei allen Affen im Dosisbereich von 6–30 µg/kg (subkutan) bei schnellem Wirkungseintritt effektiv und langanhaltend das Entzugssyndrom.[3] Der Wirkungseintritt war bei einer Dosis von 30 µg/kg subkutan geringfügig langsamer als bei Morphin, die Wirksamkeit vergleichbar und die Wirkungsdauer länger. Die Morphin-Äquivalenzdosis betrug 4 mg/kg subkutan (Potenzfaktor 133). Die Substanz könnte daher für die Behandlung der Opioidabhängigkeit bedeutsam sein.
Die signalisierende Einheit nach Gabe selektiver µ-Rezeptor-Agonisten sind offensichtlich nicht „isolierte“ µ-Rezeptoren, sondern heteromere Proteinkomplexe. Die anderen Rezeptoren können einen modulierenden Einfluss auf die über aktivierte µ-Rezeptoren ausgelösten Signalkaskaden und damit das gesamte Spektrum an Wirkungen und Nebenwirkungen ausüben. Die gleichzeitige Gabe von µ-Agonisten zusammen mit Liganden, die selektiv an einen weiteren der oben genannten Rezeptoren binden, kann deshalb das Wirkungsspektrum der µ-Agonisten beeinflussen.
Weiterhin kann die Heteromerenbildung durch µ-Agonisten (oder allgemein durch Agonisten) beeinflusst werden. Derartige Rezeptor-Heteromere können bei chronischer Gabe von Agonisten – im Vergleich zur akuten Gabe – zu Veränderungen in der Kopplung des Rezeptors zu intrazellulären Signalproteinen (z. B. G-Proteine) führen.[5] Von besonderer Bedeutung sind in diesem Zusammenhang κ-Opioid- und δ-Opioidrezeptoren. In einer Reihe von Studien wurde gezeigt, dass κ-Agonisten (U-50488, Nalfurafin (TRK-820)) die Entwicklung von Toleranz und körperlicher Abhängigkeit sowie die zur Selbstverabreichung führenden psychotropen Effekte vermindern oder blockieren können,[6][7][8] während κ-Antagonisten (Norbinaltorphimin),[9] diese verstärken, wenn sie kurz vor oder zusammen mit Morphin verabreicht werden. Bei den δ-selektiven Liganden verhält sich das ganze umgekehrt. Hier wird durch Koapplikation von Morphin mit δ-Antagonisten wie NTI, 5’-NTII,[10][11][12] TIPP-Ψ[13] oder BW373U86[14] die Entwicklung von Toleranz und körperlicher Abhängigkeit vermindert oder blockiert, ohne dabei die analgetische Wirkung zu beeinflussen.
δ-Agonisten hingegen verstärken die Entwicklung von Toleranz und körperlicher Abhängigkeit unter chronischer Morphingabe. Die Wirkung dieser 2-Wirkstoff-Kombinationen hängt davon ab, ob direkt benachbarte Bindungsstellen eines µ-κ- bzw. µ-δ-Heteromers besetzt werden. Dies kann am effektivsten erreicht werden, indem man den µ-Agonisten über einen Spacer definierter Länge an den zweiten Liganden bindet. Beim µ-δ-Heteromer wird vermutet, eine funktionelle Einheit zu sein, die für die Abhängigkeitsentwicklung von Bedeutung ist. Daher wurden bivalente Liganden aus einem µ-Agonisten und einem δ-Antagonisten detaillierter untersucht.[2]
Einfluss der Spacer-Länge auf die Toleranz- und Abhängigkeitsentwicklung
Durch Variation der Länge des Spacers kann die psychotrope Wirkung und die Toleranz- und Abhängigkeitsentwicklung beeinflusst werden.[2][3][4] MDAN-16 (der Ligand mit dem kürzesten Spacer) induziert Toleranz und physische Abhängigkeit, vergleichbar mit Morphin. MDAN-17 und MDAN-18 induzieren Toleranz, aber keine physische Abhängigkeit und MDAN-19 bis MDAN-21 induzieren weder Toleranz noch physische Abhängigkeit. MDAN-16 führt darüber hinaus zur Selbstverabreichung, nicht aber MDAN-19 bis MDAN-21. Daraus kann abgeleitet werden, dass diese Derivate vermutlich kein oder höchstens ein geringes Missbrauchspotential aufweisen.
Der Opioidrezeptor bildet Proteinkomplexe aus verschiedenen Proteinen aus (Heteromere). Dazu gehören z. B. Heteromere (und auch Oligomere) vom Typ µ-δ, µ-κ, µ-sst2A, µ-NK1, µ-CB1, µ-A1, µ-mGluR5, µ-ORL1, µ-α2A, µ-CCR5, µ-5-HT1A und µ-GRPR.[15][16] Die Mechanismen, über die das µ-δ-Heteromer Toleranz und körperliche Abhängigkeit induziert, bzw. wie diese durch δ-Antagonisten blockiert werden, sind bisher nicht bekannt. Allerdings konnte an Zellen, die nur µ-Rezeptoren exprimieren gezeigt werden, dass deren Aktivierung nur inhibitorische Effekte auslöst, während in Zellen, die µ- und δ-Rezeptoren exprimieren eine exzitatorische Reaktion erfolgt.[17] Ein Umschalten der µ-Rezeptoren vom inhibitorischen in den exzitatorischen Modus (der Rezeptor koppelt dann an statt zu inhibitorischen Gi/Go-Proteinen zu exzitatorischen Gs-Proteinen) wurde bereits früher von Crain und Shen wiederholt bei Untersuchungen zu den biochemischen Mechanismen der Opioidabhängigkeit bei chronischer Opioidgabe untersucht und beschrieben (vgl. „exzitatorische Supersensibilität“).[18] Im MDAN-21 moduliert der δ-Antagonist (7'-Aminonaltrindol) die Wirkung des µ-Agonisten (Oxymorphamin) offensichtlich dadurch, dass durch die Blockierung des δ-Rezeptors eine allosterische Kopplung zum µ-Rezeptor beeinflusst wird, was Auswirkungen auf die Kopplung des µ-Rezeptor zu intrazellulären Signalproteinen oder regulatorisch wirkenden Proteinen (z. B. G-Proteine, β-Arrestine etc.) hat. Damit werden letztendlich intrazelluläre Signalkaskaden beeinflusst, die für die Wirkungen/Nebenwirkungen verantwortlich sind.
Geschichte
Die Grundlagen, die zur Entwicklung derartiger bivalenter Opioid-Liganden führten, gehen auf die frühen 90er Jahre zurück, als man erkannte, dass die Prä- oder Koapplikation von δ- und κ-Opioidrezeptor-Liganden zusammen mit Morphin dessen analgetische Wirkung verstärken und die Toleranz- und Abhängigkeitsentwicklung sowie die zur Selbstverabreichung führenden psychischen Effekte vermindern kann. Weitere Untersuchungen führten zu der Erkenntnis, dass der µ-Opioid-Rezeptor Heteromere mit zahlreichen anderen Rezeptoren bilden kann.
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d David J. Daniels, Natalie R. Lenard, Chris L. Etienne, Ping-Yee Law, Sandra C. Roerig, Philip S. Portoghese: Opioid-induced tolerance and dependence in mice is modulated by the distance between pharmacophores in a bivalent ligand series. In: Proceedings of the National Academy of Sciences of the United States of America. Band 102, Nr. 52, Dezember 2005, S. 19208–19213, doi:10.1073/pnas.0506627102.
- ↑ a b c d Mario D. Aceto, Louis S. Harris, S. Stevens Negus, Matthew L. Banks, Larry D. Hughes, Eyup Akgün, Philip S. Portoghese: MDAN-21: A Bivalent Opioid Ligand Containing mu-Agonist and Delta-Antagonist Pharmacophores and Its Effects in Rhesus Monkeys. In: International Journal of Medicinal Chemistry. Band 2012, April 2012, S. 1–6, doi:10.1155/2012/327257.
- ↑ a b c Natalie R. Lenard, David J. Daniels, Philip S. Portoghese, Sandra C. Roerig: Absence of conditioned place preference or reinstatement with bivalent ligands containing mu-opioid receptor agonist and delta-opioid receptor antagonist pharmacophores. In: European Journal of Pharmacology. Band 566, Nr. 1–3, Juli 2007, S. 75–82, doi:10.1016/j.ejphar.2007.02.040.
- ↑ M. Gomez-Soler u. a.: On the Role of G-Protein-coupled Receptors Oligomerization. In: The Open Biology Journal. 4, 2001, S. 47.
- ↑ Tsuneyuki Yamamoto, Masuo Ohno, Showa Ueki: A selective κ-opioid agonist, U-50,488H, blocks the development of tolerance to morphine analgesia in rats. In: European Journal of Pharmacology. Band 156, Nr. 1, Oktober 1988, S. 173–176, doi:10.1016/0014-2999(88)90162-8.
- ↑ Pao-Luh Tao, Chyi-Lin Hwang, Chin-Yuan Chen: U-50,488 blocks the development of morphine tolerance and dependence at a very low dose in guinea pigs. In: European Journal of Pharmacology. Band 256, Nr. 3, Mai 1994, S. 281–286, doi:10.1016/0014-2999(94)90553-3.
- ↑ Minoru Tsuji, Hiroshi Takeda, Teruhiko Matsumiya, Hiroshi Nagase, Mitsuaki Yamazaki, Minoru Narita, Tsutomu Suzuki: A novel κ-opioid receptor agonist, TRK-820, blocks the development of physical dependence on morphine in mice. In: Life Sciences. Band 66, Nr. 25, Mai 2000, S. PL353–PL358, doi:10.1016/S0024-3205(00)80011-9.
- ↑ Tsutomu Suzuki, Minoru Narita, Yuki Takahashi, Miwa Misawa, Hiroshi Nagase: Effects of nor-binaltorphimine on the development of analgesic tolerance to and physical dependence on morphine. In: European Journal of Pharmacology. Band 213, Nr. 1, März 1992, S. 91–97, doi:10.1016/0014-2999(92)90237-X.
- ↑ E. E. Abdelhamid, M. Sultana, P. S. Portoghese, A. E. Takemori: Selective blockage of delta opioid receptors prevents the development of morphine tolerance and dependence in mice. In: Journal of Pharmacology and Experimental Therapeutics. Band 258, Nr. 1, Juli 1991, S. 299–303 (aspetjournals.org).
- ↑ Y. Miyamoto, P. S. Portoghese, A. E. Takemori: Involvement of delta 2 opioid receptors in the development of morphine dependence in mice. In: Journal of Pharmacology and Experimental Therapeutics. Band 264, Nr. 3, März 1993, S. 1141–1145 (aspetjournals.org).
- ↑ Tsutomu Suzuki, Minoru Tsuji, Tomohisa Mori, Miwa Misawa, Hiroshi Nagase: Effect of naltrindole on the development of physical dependence on morphine in mice: A behavioral and biochemical study. In: Life Sciences. Band 57, Nr. 17, September 1995, S. PL247–PL252, doi:10.1016/0024-3205(95)02139-A.
- ↑ M. E. Fundytus, P. W. Schiller, M. Shapiro, G. Weltrowska, T. J. Coderre: Attenuation of morphine tolerance and dependence with the highly selective delta-opioid receptor antagonist TIPP[psi]. In: European Journal of Pharmacology. Band 286, Nr. 1, November 1995, S. 105–108, PMID 8566146.
- ↑ P. H. Lee, R. W. McNutt, K. J. Chang: A nonpeptidic delta opioid receptor agonist, BW373U86, attenuates the development and expression of morphine abstinence precipitated by naloxone in rat. In: Journal of Pharmacology and Experimental Therapeutics. Band 267, Nr. 2, November 1993, S. 883–887 (aspetjournals.org).
- ↑ Cynthia Wei-Sheng Lee, Ing-Kang Ho: Pharmacological Profiles of Oligomerized μ-Opioid Receptors. In: Cells. Band 2, Nr. 4, Oktober 2013, S. 689–714, doi:10.3390/cells2040689.
- ↑ Susan R. George, Brian F. O’Dowd, Samuel P. Lee: G-Protein-coupled receptor oligomerization and its potential for drug discovery. In: Nature Reviews Drug Discovery. Band 1, Nr. 10, Oktober 2002, S. 808–820, doi:10.1038/nrd913.
- ↑ A. C. Charles u. a.: Coexpression of δ-Opioid-Receptors with µ-Receptors in GH2 Cells Change the Functional Response to µ-Agonists from Inhibitory to Excitatory. In: Mol. Pharmacol. 63, 1, 2003, S. 89.
- ↑ Stanley M Crain, Ke-Fei Shen: Modulation of opioid analgesia, tolerance and dependence by Gs-coupled, GM1 ganglioside-regulated opioid receptor functions. In: Trends in Pharmacological Sciences. Band 19, Nr. 9, September 1998, S. 358–365, doi:10.1016/S0165-6147(98)01241-3.