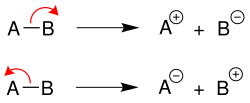
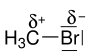Heterolytische Spaltung
Bei einer heterolytischen Spaltung verbleiben die Bindungselektronen an einem Bindungspartner, es entstehen somit je ein Kation und ein Anion.[1] Dabei nimmt das elektronegativere Atom [im Beispiel B (oben) oder A (unten)] die negative Ladung auf:
Anorganische Chemie
[Bearbeiten | Quelltext bearbeiten]Bei Säure-Base-Reaktionen nach Brønsted wird von dieser Art der Bindungsspaltung ausgegangen. Eine Säure spaltet ein Wasserstoff-Kation H+ ab, das zurückbleibende Teilchen wird zum Anion. Starke Säuren, die „leicht“ ein H+-Ion abspalten, besitzen demnach eine tiefere heterolytische Bindungsenergie als schwache Säuren.
Organische Chemie
[Bearbeiten | Quelltext bearbeiten]Die heterolytische Spaltung ist in der organischen Chemie oft nur ein Grenzfall, da meistens keine isolierten Ionen auftreten, sondern die Bindungen nur polarisiert sind; d. h. die Bindungspartner haben eine Partialladung δ+ oder δ−. Im Brommethan ist beispielsweise die C–Br-Bindung polarisiert, das Kohlenstoffatom besitzt eine positive Partialladung (δ+), das Bromatom eine negative Partialladung (δ−):
Die Heterolyse von Brommethan besitzt nur untergeordnete Bedeutung, da thermodynamisch ungünstig:
Das Methyl-Kation besetzt nur eine geringe Stabilität.
Deutlich leichter verläuft die Heterolyse von tert-Butylbromid, da das gebildete tertiäre Carbeniumion stabiler ist als das primäre Methyl-Carbeniumion, das aus Brommethan gebildet werden kann:
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 1693.