Aluminiumselenid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
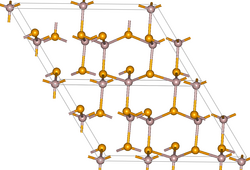
| ||||||||||||||||
| _ Al3+ _ Se2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Aluminiumselenid | |||||||||||||||
| Andere Namen |
Aluminium(III)-selenid | |||||||||||||||
| Verhältnisformel | Al2Se3 | |||||||||||||||
| Kurzbeschreibung |
bräunlicher geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 290,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,437 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
zerfällt zu Al(OH)3 und H2Se in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Aluminiumselenid ist eine anorganische chemische Verbindung des Aluminiums aus der Gruppe der Selenide.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Aluminiumselenid kann durch Reaktion von Aluminium mit Selen bei 1000 °C gewonnen werden.[4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Aluminiumselenid ist ein feuchtigkeitsempfindlicher gelb- bis bräunlicher Feststoff, der sich in Wasser zu Aluminiumhydroxid und Selenwasserstoff zersetzt.[2]
Der Reinstoff ist weiß, das Handelsprodukt jedoch meist gelb- oder bräunlich.[5] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe Cc (Raumgruppen-Nr. 9) und den Gitterparametern a = 1168 pm, b = 673 pm, c = 733 pm und α = 121,1° sowie vier Formeleinheiten pro Elementarzelle. Die Verbindung ist ein Halbleiter.[6]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Aluminiumselenid wird als Ausgangsstoff zur Herstellung von Selenwasserstoff in der Halbleiterproduktion verwendet.[5][4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Aluminum selenide, 99% (metals basis) bei Alfa Aesar, abgerufen am 7. August 2013 (Seite nicht mehr abrufbar).
- ↑ a b Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 172 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis, 2011, ISBN 1-4398-1462-7, S. 12 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b G. R. Waitkins, R. Shutt, Irvin W. Kinney, James P. McReynolds: Aluminum Selenide and Hydrogen Selenide. In: W. Conard Fernelius (Hrsg.): Inorganic Syntheses. Vol. 2. John Wiley & Sons, Inc., 2007, ISBN 978-0-470-13233-3, S. 183–186, doi:10.1002/9780470132333.ch55.
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer, 1998, ISBN 3-642-58842-5, S. 302 (eingeschränkte Vorschau in der Google-Buchsuche).




