Diisocyanate
| Diisocyanat-Monomere (Auswahl) |
Allgemeine Struktur eines Diisocyanates. Die Isocyanat-Gruppen sind blau markiert, R ist ein zweibindiger organischer Rest (z. B. eine para-Phenylengruppe). |
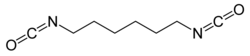 Hexamethylen-1,6-diisocyanat (HDI) |
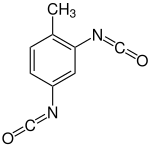 Toluol-2,4-diisocyanat (TDI) |
 Diphenylmethan-4,4'-diisocyanat (MDI) |
 Isophorondiisocyanat (IPDI) |
Diisocyanate sind organische Verbindungen, die zwei Isocyanatgruppen (–N=C=O) enthalten und sind eine Untergruppe der Polyisocyanate. Sie sind technisch wichtige Rohstoffe für die Herstellung von Polyurethanen (z. B. „Bauschaum“) und Polyharnstoffen. Sie können in aliphatische und aromatische Isocyanate eingeteilt werden.
Vertreter
[Bearbeiten | Quelltext bearbeiten]Aliphatische Diisocyanate
[Bearbeiten | Quelltext bearbeiten]Aliphatische und cycloaliphatische Isocyanate werden aufgrund ihrer Lichtbeständigkeit hauptsächlich bei Lacken eingesetzt. Sie verfügen über eine hohe Härte, neigen aber dazu spröde auf mechanische Belastungen zu reagieren. Durch Verwendung von anderen Aminoalkoholen kann man die Flexibilität der Stoffe einstellen. Die wichtigsten Vertreter sind:
TDI wird in der Regel als technisches Gemisch aus den beiden Isomeren Toluol-2,4-diisocyanat und Toluol-2,6-diisocyanat als TDI-65, TDI-80 oder TDI-100 eingesetzt. Die Bezeichnung gibt dabei den Anteil des reaktiveren 2,4-Isomer an, so enthält der wichtigste Typ TDI-80 die beiden 2,4- und 2,6-Isomere im Verhältnis 80/20.[1]
Aromatische Diisocyanate
[Bearbeiten | Quelltext bearbeiten]Die aromatischen Polyisocyanate weisen aufgrund des aromatischen Restes eine höhere Reaktivität gegenüber Hydroxygruppen auf und werden daher bevorzugt in PUR-Anwendungen eingesetzt. Insbesondere MDI und TDI werden zur Herstellung von Polyurethanen verwendet, die etwa als Schaumstoffe oder in Lacken eingesetzt werden.[1] Sie sind im Gegensatz zu aliphatischen Polymere flexibler. Die wichtigsten Vertreter sind:
- TDI – Toluylendiisocyanat
- MDI – Diphenylmethandiisocyanat (dieses enthält oft als Nebenbestandteil PMDI – Polymeres Diphenylmethandiisocyanat, mit mehr als zwei Isocyanatgruppen)
Herstellung
[Bearbeiten | Quelltext bearbeiten]Diisocyanate werden aus Diaminen[2] durch Umsetzung mit Phosgen (COCl2) hergestellt:

Der Reaktionsverlauf entspricht der Umsetzung von primären Aminen mit Phosgen.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Diisocyanate treten oft als farblose bis gelbliche Flüssigkeiten auf, zum Teil auch als Feststoffe mit niedrigen Schmelzpunkten. Sie wirken stark reizend und giftig, unter anderem beim Einatem und können zudem sensibilisierend wirken.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Zur Herstellung von Polyurethanen werden Diisocyanate mit Diolen (z. B. Ethylenglycol) umgesetzt:

Wird die Polyaddition zur Polyurethan-Herstellung in Gegenwart einer geringen Menge Wasser durchgeführt, bildet sich durch die Hydrolyse von Isocyanat auch etwas CO2. Das Kohlendioxid entweicht, dabei wird das Polyurethan aufgebläht. So entsteht ein Polyurethanschaum, der Verwendung als Polster (Möbel, Kraftfahrzeuge) findet. Polyurethane zählen zur Gruppe der Polyaddukte und werden auch in anderen Industriezweigen und im Bauwesen vielfältig eingesetzt.[5][6] Die Polyadditions-Reaktionen von Polyisocyanaten mit Diolen (zweiwertigen Alkoholen) beziehungsweise Polyolen (mehrwertigen Alkoholen) sind die Grundlage der Polyurethan-Chemie. Für Polyurethan-Lacke und -Klebstoffe wird vor allem Diphenylmethandiisocyanat verwendet, das der industriell bedeutendste Vertreter ist. Andere Diisocyanate werden wegen ihres hohen Dampfdrucks zunächst zu höhermolekularen Polyisocyanaten oligomerisiert. Neben der Herstellung von Polyurethanen können durch Reaktion mit Polyaminen auch Polyharnstoffe hergestellt werden sowie durch Trimerisierung Isocyanurate.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Diisocyanatotoluene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juni 2024.
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, 8. Auflage, Frank’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 926.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin 2015, ISBN 978-3-11-030559-3, S. 682–683.
- ↑ a b Eintrag zu Diisocyanate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juni 2024.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 738.
- ↑ M. D. Lechner, K. Gehrke und E. H. Nordmeier: Makromolekulare Chemie, 4. Auflage, Birkhäuser Verlag, 2010, ISBN 978-3-7643-8890-4, S. 136–138.