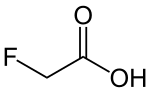
Fluoressigsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Fluoressigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3FO2 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 78,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,37 g·cm−3 (36 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
165 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
2,59 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit |
leicht in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Fluoressigsäure ist eine fluorierte organische Verbindung aus der Gruppe der Carbonsäuren. Der hochgiftige Stoff wird zur Bekämpfung von Nagetieren hergestellt. In Giftködern setzt man in der Regel nicht die freie Säure, sondern ihre Salze (Monofluoracetate) ein. Der farblose, kristalline Stoff zersetzt sich beim Erhitzen.
Vorkommen[Bearbeiten | Quelltext bearbeiten]

In der Natur findet sich das Natriumsalz Natriumfluoracetat als giftiger Inhaltsstoff in den Blättern eines südafrikanischen Strauches „Gifblaar“ („Giftblatt“, Dichapetalum cymosum). Viehfraß an dieser Pflanze kann zu einer Vergiftung führen.[4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Fluoressigsäure kann durch Reaktion von Methyliodacetat und Silber(I)-fluorid oder Methylchloracetat und Kaliumfluorid gefolgt von Ester-Hydrolyse gewonnen werden.[5]
Toxikologie[Bearbeiten | Quelltext bearbeiten]
Fluoressigsäure substituiert Essigsäure im Citratzyklus und führt auf der Stufe Citrat/cis-Aconit zur Enzymblockade (über den Metabolit Fluorocitrat) und ist daher hochtoxisch. Die letale Dosis beträgt für Menschen etwa 5 mg·kg−1. Bei Nagetieren, wie Maus oder Ratte, die einen entsprechend höheren Metabolismus haben, liegt die Dosis mit 0,1 mg·kg−1 deutlich niedriger.[6][7] Für Fische und wirbellose Wassertiere ist die Verbindung dagegen nahezu ungiftig.[8]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu Fluoressigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-42.
- ↑ Eintrag zu Fluoroacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. v. Ostertag, G. Kulenkampff: Tierseuchen und Herdenkrankheiten in Afrika. W. de Gruyter, 1941, DNB 362284067.
- ↑ Victor H. Agreda, Joseph R. Zoeller (Hrsg.): Acetic Acid and Its Derivatives. Marcel Dekker, New York u. a. 1992, ISBN 0-8247-8792-7.
- ↑ Yakkyoku, in Pharmacy. 28/1977, S. 329–339. (in Japanisch).
- ↑ J. C. Ward: Rodent control with 1080, ANTU, and other war-developed toxic agents. In: Am J Public Health Nations Health. 36/1946, S. 1427–1431.
- ↑ Pest Management Regulatory Agency, Re-evaluation of Sodium Monofluoroacetate. 18. Juni 2004 (PDF; 92 kB).


