Imidsäureester

Imidsäureester (alternative Bezeichnungen: Imidate, Carboximidate, Imidester, Imidoester, Iminoester, Iminoether) sind eine Stoffgruppe chemischer Verbindungen, die die funktionelle Gruppe R1–C(=NH)(–OR2) enthalten. Diese Verbindungen leiten sich von den Imidsäuren ab, einer tautomeren Form der Carbonsäureamide. Die Imidsäureester reagieren basisch und bilden mit Säuren Salze.[1]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Imidsäureester können aus Nitrilen durch Addition von Alkoholen in Gegenwart von wasserfreiem Chlorwasserstoff und anschließender Deprotonierung des als Zwischenprodukt gebildeten Hydrochlorids mit einer schwachen Base – beispielsweise Natriumhydrogencarbonat[2] – hergestellt werden (Pinner-Reaktion):[3]

Alternative Darstellungswege für Imidsäureester sind:
- die O-Alkylierung von Amiden mit Oxonium-Tetrafluoroborat-Salzen.[4]
- die Umsetzung einwertiger Phenole mit Nitrilen unter den Bedingungen der Houben-Hoesch-Reaktion.[5]
- N-substituierte Imidsäureester erhält man durch Umsetzung von Amino-Aromaten oder Amino-Heteroaromaten mit Orthocarbonsäureestern.
- Cyclische Imidsäureester – beispielsweise 2-Oxazolin (4,5-Dihydro-1,3-oxazol) – erhält man durch Umsetzung von Aminoalkoholen mit Carbonsäuren, bzw. Carbonsäurechloriden unter Wasserabspaltung (Beispiel:2-Ethyl-2-oxazolin).
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Unter neutralen Bedingungen sind Imidsäureester gegenüber Wasser relativ stabil. Beim Erhitzen von Arylimidsäureestern bilden sich die N,N-Diarylamide (Chapman-Umlagerung).[6] Durch Umsetzung von Imidsäureester-Hydrochloriden mit wasserfreiem Ammoniak erhält man Amidine.[1]
Beispiel:

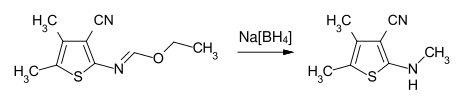
Mit Metallhydriden oder komplexen Hydriden, wie Natriumborhydrid, lassen sich N-substituierte Imidsäureester zu sekundären bzw. tertiären Aminen reduzieren.[7]
Beispiel:
Literatur
[Bearbeiten | Quelltext bearbeiten]- Stanley Sandler und Wolf Karo: Organic Functional Group Preparations. 2. Auflage. Academic Press, San Diego 1989, S. 314–350.
- H. Pielartzik, B. Irmisch-Pielartzik, Theophil Eicher: Carbonsäure-ester-imide, hydroximide, -hydrazonide bzw. 1-Alkoxy-1-diazo-alkane. In: Houben-Weyl. Methods of Organic Chemistry. 4. Auflage. E 5. Georg Thieme Verlag, Stuttgart, New York 1985, ISBN 978-3-13-217504-4, S. 812 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 230.
- ↑ Michael B. Smith, Jerry March: March's Advanced Organic Chemistry. Reactions, Mechanisms and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 1275 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Imidsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Februar 2019.
- ↑ Hartwig Perst: Oxonium Ions in Organic Chemistry. Verlag Chemie, 1971, ISBN 3-527-25348-3, S. 128–137 (englisch).
- ↑ Michael B. Smith, Jerry March: March's Advanced Organic Chemistry. Reactions, Mechanisms and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 732 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael B. Smith, Jerry March: March's Advanced Organic Chemistry. Reactions, Mechanisms and Structure. 6. Auflage. John Wiley & Sons, Hoboken, New Jersey 2007, ISBN 978-0-471-72091-1, S. 1697 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Andor Hajós: Reduktion mit Metallhydriden bzw. komplexen Hydriden. In: Houben-Weyl. Methoden der Organischen Chemie. 4. Auflage. IV/1d Reduktion Teil II. Georg Thieme Verlag, Stuttgart, New York 1981, ISBN 978-3-13-217504-4, S. 812 ff. (eingeschränkte Vorschau in der Google-Buchsuche).