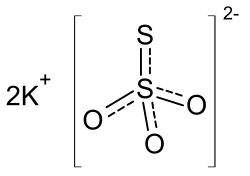
Kaliumthiosulfat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumthiosulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | K2S2O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 190,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
2,37 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Kaliumthiosulfat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Thiosulfate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Kaliumthiosulfat kann durch Reaktion von Kaliumcarbonat mit Schwefel gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Kaliumhydroxid mit Schwefel und anschließende Oxidation des entstandenen Kaliumpolysulfides.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Kaliumthiosulfat ist ein weißer Feststoff, der sehr leicht löslich in Wasser ist.[1] Kaliumthiosulfat ist pH-Wert empfindlich und wird bei einem pH-Wert unter 5,5 und über 8,5 instabil.[5] Die Kristallstruktur des wasserfreien Kaliumthiosulfats ist monoklin mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) (a = 1010,15(14), b = 910,65(12), c = 1329,4(2) pm, β = 111,984°(11), Z = 8, R1 = 0,0665). Sie weist zwei kristallographisch unterschiedliche Thiosulfatanionen auf, insgesamt koordiniert durch 9/10 Kaliumkationen. Ihre Anordnung in der Struktur führt zu einer komplexen Struktur mit einer pseudo-orthorhombischen Einheitszelle. Die Kristallstruktur des noch komplizierter aufgebauten 1/3-Hydrates ist ebenfalls monoklin mit der P21/c (Nr. 14) (a = 938,27(6), b = 602,83(4), c = 3096,0(2) pm, β = 98,415°(6), Z = 12, R1 = 0.0327).[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kaliumthiosulfat wird als Flüssigdünger eingesetzt, der Kalium und Schwefel liefert.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Kaliumthiosulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. April 2019. (JavaScript erforderlich)
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 81 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Max Biechele: Pharmazeutische Übungspräparate Anleitung zur Darstellung, Erkennung, Prüfung und stöchiometrischen Berechnung von offizinellen chemisch-pharmazeutischen Präparaten. Springer-Verlag, 2013, ISBN 978-3-662-32756-2, S. 162 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patentanmeldung EP3208234A1: Oxidationsverfahren zur Herstellung von Kaliumthiosulfat. Angemeldet am 18. Februar 2016, veröffentlicht am 23. August 2017, Anmelder: Tessenderlo Kerley Inc, Erfinder: Michael Massoud Hojjatie et al.
- ↑ Western Plant Health Association: Western Fertilizer Handbook Third Horticulture Edition. Waveland Press, 2018, ISBN 1-4786-3884-2, S. 186 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anna J. Lehner, Lisa V. Schindler, Caroline Röhr: Kristallstrukturen der Alkalimetall-Thiosulfate A2S2O3 nH2O (A/n = K/0, K/⅓ , Rb=1) / Crystal Structures of the Alkali Thiosulfates A2S2O3 - nH2O (A/n = K/0, K/⅓ , Rb=1). In: Zeitschrift für Naturforschung B. 68, 2013, S. 323, doi:10.5560/ZNB.2013-3089.
- ↑ FIFA: Australian Soil Fertility Manual. Csiro Publishing, 2006, ISBN 978-0-643-09021-7, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
