Schwefeloxide
Als Schwefeloxide (allgemeine Formel SxOy) bezeichnet man die Oxide des chemischen Elements Schwefel.
Da Schwefel unterschiedliche Oxidationszahlen annehmen kann, gibt es mehrere verschiedene Schwefeloxide.
| Oxidations- stufe des Schwefels |
Summen- formel |
Bezeichnung | Strukturformel |
|---|---|---|---|
| < +1 | SnO mit n = 5...10 |
Polyschwefelmonoxide | |
| < +1 | S7O2 | Heptaschwefeldioxid | 
|
| +1 | S2O | Dischwefelmonoxid | 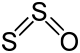
|
| +2 | SO | Schwefelmonoxid | |
| +2 | S2O2 | Dischwefeldioxid | |
| +4 | SO2 | Schwefeldioxid | 
|
| +6 | SO3 | Schwefeltrioxid | 
|
| +6 | SO4 | Schwefeltetroxid | 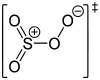
|
| +6 | (SO3...4)n | Polyschwefelperoxid |
Schwefeloxide entstehen bei der Verbrennung von Schwefel und schwefelhaltigen Brennstoffen (Holz, Kohle, Benzin, Heizöl, Dieselkraftstoff, Biomasse), außerdem beim Rösten von sulfidischen Erzen zur Metallgewinnung (Metallurgie) aber auch bei natürlichen Vorgängen wie beispielsweise bei Vulkanausbrüchen.
Schwefel bildet bei Verbrennungsvorgängen vor allem zwei Oxide:
- Schwefeldioxid, SO2 und
- Schwefeltrioxid, SO3 (in geringeren Konzentrationen)
Beide Schwefeloxide bilden in wässriger Lösung Säuren. Aus Schwefeldioxid entsteht so die unbeständige Schweflige Säure zusammen mit der tautomeren Sulfonsäure, aus Schwefeltrioxid die sehr wichtige Schwefelsäure. Beide Säuren spielen u. a. bei der Versauerung von Seen durch sauren Regen und beim Waldsterben eine Rolle. Außerdem führt sauerer Regen zur Korrosion von Bauwerken wie Kirchen und von Marmor-Skulpturen. Beide Schwefeloxide sind auch als Gase giftig, sie sind aber von größter wirtschaftlicher Bedeutung für die industrielle Herstellung von Schwefelsäure.
Im Rahmen des Bundes-Immissionsschutzgesetzes und seiner Folgevorschriften sowie analoger Umweltgesetze wird der Begriff Schwefeloxid als Summenparameter für beide Schwefeloxide benutzt, die Angabe erfolgt als Äquivalent zum Schwefeldioxid.
Weitere Schwefeloxide sind die Polyschwefelmonoxide SnO (mit n = 5...10). Diese sind Suboxide, bei denen die Schwefelatome im Durchschnitt eine Oxidationszahl niedriger als +I haben, tatsächlich aber verschiedene Oxidationszahlen aufweisen. Prominentester Vertreter ist das Cyclooctaschwefelmoxid S8O. Darüber hinaus gibt es auch noch die Schwefelperoxide SO4 und (SO3–4)n, die Oxidationszahl des Schwefels beträgt dabei +VI.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Ralf Steudel: Sulfur-Rich Oxides SnO and SnO2 (n>1). In: Top. Curr. Chem. 231, 2003, S. 203–230. doi:10.1007/b13185
- Ralf Steudel: Chemie der Nichtmetalle: Synthesen – Strukturen – Bindung – Werwendung, 4. Auflage, de Gruyter, Berlin/Boston, 2013, S. 489–495. ISBN 978-3-11-030439-8
- Ralf Steudel, David Scheschkewitz: Chemistry of the Non-Metals; Syntheses – Structures – Bonding – Applications, 2. Auflage, de Gruyter, Berlin/Boston, 2020, S. 555–564. ISBN 978-3-11-057805-8
- M. W. Wong, Y. Steudel, R. Steudel: Structures and vibrational spectra of the sulfur-rich oxides SnO (n = 4–9): the importance of π*-π* interactions. In: Chemistry European Journal. 13(2), 2007, S. 502–514. PMID 17013961
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ E. Riedel, C. Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter, Berlin/ Boston 2015, ISBN 978-3-11-035528-4, S. 469–472, (abgerufen über De Gruyter Online).