Schwefeltrioxid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Schwefeltrioxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SO3 | |||||||||||||||
| Kurzbeschreibung |
farblose, an der Luft rauchende Masse (γ-Form)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest (α-, β-Form), flüssig (γ-Form) | |||||||||||||||
| Dichte |
2,00 g·cm−3 (γ-Form)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
44,45 °C (β-, γ-Form), α-Form zersetzt sich bei 50 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
explosionsartige Hydrolyse in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Schwefeltrioxid, SO3, ist das Anhydrid der Schwefelsäure. Es bildet bei Normbedingungen farblose, nadelförmige Kristalle, die äußerst hygroskopisch sind und sehr heftig (explosiv) mit Wasser reagieren. Es existieren für den Feststoff Schwefeltrioxid drei verschiedene Modifikationen. Einatmen hat Reizerscheinungen zur Folge, in der Lunge wird daraus Schwefelsäure, die ein lebensgefährliches Lungenödem auslösen kann.

Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Schwefeltrioxid wird technisch im Kontaktverfahren durch mit Vanadiumpentoxid katalysierte Oxidation von Schwefeldioxid mit Luftsauerstoff bei 420 °C hergestellt. Reines Schwefeltrioxid erhält man durch Abdestillieren aus Oleum, welches ein Zwischenprodukt bei der Schwefelsäureherstellung ist. Das zunächst gasförmige abdestillierte Schwefeltrioxid wird anschließend durch Kühlung zu flüssigem Schwefeltrioxid kondensiert. Bei Kondensation und Lagerung sind enge Temperaturgrenzen einzuhalten, da Festpunkt und Siedepunkt sehr nahe beieinander liegen.
Um kleinere Mengen Schwefeltrioxid zu erhalten, kann man es auch aus einer Mischung von Schwefelsäure und Phosphorpentoxid oder Metaphosphorsäure (H4P4O12, cyclo-Phosphat) abdestillieren. Schwefeltrioxid lässt sich jedoch auch durch die Oxidation von Schwefeldioxid mit Stickstoffdioxid darstellen.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
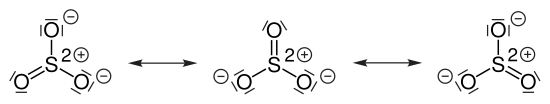
Das Schwefeltrioxid-Molekül kann durch drei gleichwertige mesomere Grenzstrukturen beschrieben werden:
Es liegt im Gleichgewicht mit S3O9-Molekülen vor. Wird (gasförmiges) SO3 unter −80 °C abgekühlt, bildet sich das sog. γ-SO3. Dieses besteht aus S3O9-Molekülen. Es ist nicht planar aufgebaut, sondern formt einen gewellten Ring. Dabei sind die Schwefelatome von Sauerstoff verzerrt tetraedisch umgeben.
Schwefeltrioxid verkohlt augenblicklich Gummi und die meisten Kunststoffe wie PVC, nur spezielle Kunststoffe wie beispielsweise Teflon und Perfluoralkoxy[3] sind relativ beständig.
Molekülgeometrie[Bearbeiten | Quelltext bearbeiten]
Gasförmiges Schwefeltrioxid liegt als Monomer vor und besitzt gemäß dem VSEPR-Modell eine trigonal-planare Molekülgeometrie. Die drei OSO-Winkel betragen dabei 120°. Die drei gleich langen Doppelbindungen haben eine Länge von 143 pm.[4]
Schwefeltrioxid besitzt als Molekülsymmetrie die Punktgruppe D3h.[4]
Verwendung und Vorkommen[Bearbeiten | Quelltext bearbeiten]
Gasförmiges Schwefeltrioxid dient hauptsächlich zur Herstellung von Schwefelsäure:
In Wasser löst sich das gasförmige SO3 nur sehr langsam und wird daher in konzentrierte Schwefelsäure eingeleitet, wobei sich Dischwefelsäure (H2S2O7) bildet. Mit Wasser wird diese dann zu Schwefelsäure umgesetzt:
Weiter zur Herstellung von Fluorsulfonsäure und Chlorsulfonsäure
Vermischt man Schwefeltrioxid mit Alkoholen, entstehen Schwefelsäureester:
Diese Reaktion wird bei der Herstellung von Tensiden genutzt:
Die Schwefelsäureester werden mit Natronlauge neutralisiert und liefern so Fettalkoholsulfate. Weiter ist Schwefeltrioxid als Oxidationsmittel geeignet. Es wurde auch zur Herstellung von Rauchgranaten benutzt, da bereits ein Tropfen flüssiges Schwefeltrioxid einen großen Raum komplett einnebeln kann.
Schwefeltrioxid ist in Portlandzement typisch mit rund 3 Gew.-% enthalten und in Baukalk nach DIN EN 459-1 meist auf 2 Gew.-% begrenzt.
Messtechnische Erfassung von Schwefeltrioxid-Emissionen[Bearbeiten | Quelltext bearbeiten]
Schwefeltrioxid-Emissionen können mit einem Kondensationsverfahren ermittelt werden, bei dem ein Teilstrom des zu beprobenden Abgases mittels einer beheizten Entnahmesonde dem Abgas entnommen und in ein Kondensationsgefäß geleitet wird. Die Randbedingungen im Kondensationsgefäß bewirken, dass Schwefeltrioxid als Schwefelsäure abgeschieden wird. Die quantitative Bestimmung des Sulfats erfolgt per Ionenchromatographie oder Titration.[5]
Eine weitere Methode zur Messung von Schwefeltrioxid ist das 2-Propanol-Verfahren. Bei diesem Verfahren wird das beladene Abgas durch eine Lösung mit 2-Propanol geleitet. Im Gegensatz zu Schwefeldioxid wird Schwefeltrioxid durch diese Lösung sehr gut absorbiert. Nach Abschluss der Probenahme wird das absorbierte Schwefeltrioxid mit einer Bariumperchloratlösung gegen Thorin titriert.[6][7] Dieses Verfahren hat sich in der Praxis nicht bewährt.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu Schwefeltrioxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- ↑ a b c d e f g Eintrag zu Schwefeltrioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ PFA Chemical Tubing. Abgerufen am 25. März 2023 (englisch).
- ↑ a b A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 642 (eingeschränkte Vorschau in der Google-Buchsuche). (abgerufen über De Gruyter Online).
- ↑ VDI 2462 Blatt 2:2011-11 Messen gasförmiger Emissionen; Bestimmung von Schwefeltrioxid in wasserdampfhaltigen Abgasen; Kondensationsverfahren (Measurement of gaseous emissions; Determination of sulphur trioxide in water vapour containing exhaust gas; Condensation method). Beuth Verlag, Berlin. S. 3.
- ↑ Wolfgang Guse: Schwefeltrioxid in Feuerungsabgasen. In: Staub – Reinhalt. Luft. 41, Nr. 6, 1981, ISSN 0949-8036, S. 204–210.
- ↑ VDI 2462 Blatt 7:1985-03 Messen gasförmiger Emissionen; Messen der Schwefeltrioxid-Konzentration; 2-Propanol-Verfahren (Measurement of Gaseous Emissions; Measurement of the Sulfur-Trioxide Concentration; 2-propanol method). VDI-Verlag, Düsseldorf, S. 2.
- ↑ VDI 2462 Blatt 2:2011-11 Messen gasförmiger Emissionen; Bestimmung von Schwefeltrioxid in wasserdampfhaltigen Abgasen; Kondensationsverfahren (Measurement of gaseous emissions; Determination of sulphur trioxide in water vapour containing exhaust gas; Condensation method). Beuth Verlag, Berlin, S. 2.