Cadmiumacetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
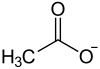
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cadmiumacetat | ||||||||||||||||||
| Andere Namen |
Essigsaures Cadmium | ||||||||||||||||||
| Summenformel | C4H6CdO4 | ||||||||||||||||||
| Kurzbeschreibung |
farblose säulenförmige Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 230,50 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
leicht in Wasser (2,01 g·ml−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Cadmiumacetat ist eine chemische Verbindung des Cadmiums und ein Salz der Essigsäure mit der Konstitutionsformel Cd(CH3COO)2. Es ist eine weiße, hygroskopische Substanz mit typischem, schwach essigartigem Geruch.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Cadmiumacetat-Dihydrat fällt aus einer wässrigen Essigsäure-Lösung aus.[5] Direkt kann es aus Cadmiumnitrat und Essigsäureanhydrid gewonnen werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Bei 130 °C gibt Cadmiumacetat-Hydrat das Kristallwasser ab und das wasserfreie Cadmiumacetat entsteht. In Wasser löst es sich mit neutralem pH-Wert. Gut löslich ist es zudem in Ethanol.[6]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Cadmiumacetat wird in der Porzellanherstellung für die Erzeugung irisierender Effekte genutzt. Zudem ist es in der analytischen Chemie ein Reagenz für den Nachweis von Schwefel, Selen und Tellur.[6]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Cadmiumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Oktober 2021. (JavaScript erforderlich)
- ↑ a b Ernst Späth: Über die Einwirkung von Essigsäureanhydrid auf Nitrate. In: Monatshefte für Chemie. 1912, 33, 3, S. 241, doi:10.1007/BF01519254.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Cadmium compounds im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Cadmiumacetat bei Merck, abgerufen am 29. August 2010.
- ↑ Arnold Willmes: Taschenbuch chemische Substanzen: Elemente - Anorganika - Organika - Naturstoffe - Polymere. 3. Auflage. Harri Deutsch, 2007, ISBN 978-3-8171-1787-1, S. 242 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Cadmiumacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Gesundheitsschädlicher Stoff bei Einatmen
- Krebserzeugender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Cadmiumverbindung
- Acetat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 23
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)




