Fluorbenzoesäuren
| Fluorbenzoesäuren | |||||||
| Name | 2-Fluorbenzoesäure | 3-Fluorbenzoesäure | 4-Fluorbenzoesäure | ||||
| Andere Namen | o-Fluorbenzoesäure | m-Fluorbenzoesäure | p-Fluorbenzoesäure | ||||
| Strukturformel | 
|
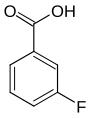
|

| ||||
| CAS-Nummer | 445-29-4 | 455-38-9 | 456-22-4 | ||||
| PubChem | 9935 | 9968 | 9973 | ||||
| Summenformel | C7H5FO2 | ||||||
| Molare Masse | 140,12 g·mol−1 | ||||||
| Aggregatzustand | fest | ||||||
| Kurzbeschreibung | weiße, kristalline Feststoffe | ||||||
| Schmelzpunkt | 122–125 °C[1] | 122–124 °C[2] | 182–184 °C[3] | ||||
| pKs-Wert[4] | 3,27 | 3,90 | 4,14 | ||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | 315‐335 | 315‐335 | 302‐318 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 261 | 261 | 280‐305+351+338 | |||||
Die Fluorbenzoesäuren (FBAs) bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Fluorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxygruppe (–COOH) und Fluor (–F) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5FO2.
Zur Stoffgruppe der Fluorbenzoesäuren zählen ebenfalls mehrfach fluorsubstituierte Benzoesäuren (z. B. 2,3-DiFBA, 2,3,4-TriFBA, 2,3,4,5,6-PentaFBA ...), welche eine Vielzahl von Isomeren mit sehr ähnlichen physikalischen Eigenschaften zulassen.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese gelingt mittels der Schiemann-Reaktion durch Diazotierung der Aminobenzoesäuren. Durch Zugabe von Tetrafluorborsäure (HBF4) wird das Diazoniumsalz als Tetrafluoroborat gefällt und anschließend vorsichtig erhitzt.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Fluorbenzoesäuren sind weiße, kristalline Feststoffe. Die Schmelzpunkte der 2- und 3-Fluorbenzoesäure unterscheiden sich fast nicht. Die 4-Fluorbenzoesäure besitzt einen deutlich höheren Schmelzpunkt, da aufgrund der höheren Symmetrie besonders starke intermolekulare Wasserstoffbrückenbindungen auftreten. Die Fluorbenzoesäuren weisen aufgrund des −I-Effekts des Fluorsubstituenten eine höhere Acidität im Vergleich zur Benzoesäure auf. Die pKs-Werte sind daher entsprechend niedriger (Benzoesäure: 4,20[4]).
2-Fluorbenzoesäure wird durch Pseudomonad zu Brenzcatechin metabolisiert.[6] 4-Fluorbenzoesäure wird durch Pseudomonas sp. B13 vollständig metabolisiert.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]FBAs werden in der Hydrogeologie als Tracer verwendet.[8] Durch ihren Einsatz werden Fließwege von Grundwasser, das Sickerverhalten von Niederschlägen im Erdreich und die Verbindung von Erdölreservoirs untereinander aufgeklärt.[9] Im Zusammenhang mit der CO2-Sequestrierung in salinen Aquiferen wird ebenfalls der Einsatz von Fluorbenzoesäuren geprüft. Sie könnten hier zur Dichtigkeitsüberwachung der unterirdischen Reservoirs dienen. Im Falle einer Undichtigkeit wären Spuren von FBAs im Grundwasser nachweisbar.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt 2-Fluorobenzoic acid bei Sigma-Aldrich, abgerufen am 29. April 2011 (PDF).
- ↑ a b Datenblatt 3-Fluorobenzoic acid bei Sigma-Aldrich, abgerufen am 29. April 2011 (PDF).
- ↑ a b Datenblatt 4-Fluorobenzoic acid bei Sigma-Aldrich, abgerufen am 29. April 2011 (PDF).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8, S. 1193.
- ↑ G. W. A. Milne, Peter Goldman, Jordan L. Holtzman: "The Metabolism of 2-Fluorobenzoic Acid", in: Journal of Biological Chemistry, 1968, 243 (20), S. 5374–5376; Abstract; PDF; 272 kB.
- ↑ A. Schreiber, M. Hellwig, E. Dorn, W. Reineke, H.-J. Knackmuss: "Critical Reactions in Fluorobenzoic Acid Degradation by Pseudomonas sp. B13", in: Appl. Environ. Microbiol., 1980, 39 (1), S. 58–67; PMC 291284 (freier Volltext).
- ↑ Q. Hu, J. E. Moran: "Simultaneous analyses and applications of multiple fluorbenzoate and halide tracers in hydrologic studies", in: Hydr. Proc., 2005, 19, S. 2671–2687.
- ↑ Th. Gieles, H.-C. Beuthan: "Einsatz von Tracern in Erdölfeldern", in: Erdgas Erdöl Kohle, 2004, 120, S. 26–29.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. Krausse und H. Dunken: "Die Kristall- und Molekülstruktur von o-Fluorbenzoesäure", in: Acta Cryst., 1966, 20, S. 67–73; doi:10.1107/S0365110X66000124.
- Karsten Müller: "Nachweis von Fluorbenzoesäuren mittels IC-UV/Vis und GC-MS", Diplomarbeit, Marburg 2008 (PDF-Datei; 15,2 MB).

