Friedel-Crafts-Acylierung
Die Friedel-Crafts-Acylierung ist eine Namensreaktion der Organischen Chemie und benannt nach Charles Friedel und James Mason Crafts. Bei der Reaktion werden Aromaten unter Lewissäure-Katalyse meist mit Carbonsäurehalogeniden umgesetzt, um einen Acylrest (Acylierung) in ein aromatisches System einzuführen. Als Wertstoff der Reaktion erhält man ein Keton. Für die Friedel-Crafts-Acylierung wird meist eine starke Lewissäure gewählt (z. B. FeCl3, BF3 oder AlCl3), die in mindestens stöchiometrischen Mengen eingesetzt wird.[1] Die Friedel-Crafts-Acylierung ist eine elektrophile aromatische Substitution.
Die Acylierung kann auch intramolekular erfolgen, beispielsweise bei der Synthese von 1-Indanon, einem bicyclischen Keton:[1]
Es gibt auch Ausführungsformen der Friedel-Crafts-Acylierung, bei denen geringere Katalysatormengen eingesetzt werden oder vollständig auf den Katalysator verzichtet werden kann.[2] Vossius beschreibt schon 1955 wesentliche Entwicklungen der Friedel-Crafts-Acylierung.[3]
Reaktionsmechanismus[Bearbeiten | Quelltext bearbeiten]
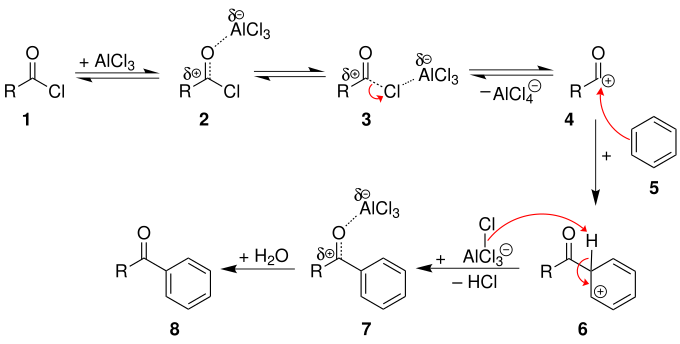
Der Mechanismus wird im folgenden Abschnitt an der Reaktion eines Carbonsäurechlorids mit Benzol erläutert. Die Friedel-Crafts-Acylierung wird dadurch eingeleitet, dass die Lewissäure an den Carbonylsauerstoff des Carbonsäurechlorids 1 koordiniert und dadurch den Carbonylkohlenstoff noch weiter positiviert (2). Allerdings kann die Lewissäure auch an das Chlor koordinieren und den gleichen Effekt auslösen (3). Dabei kann dann ein Acylium-Kation 4 entstehen, das das Benzol in einer elektrophilen aromatischen Substitution angreift und den aromatischen Charakter aufhebt. Inwiefern der Komplex aus Acylhalogenid-Lewis-Säure 2 oder ein (mesomeriestabilisiertes)[4] Acylium-Kation 4 das aktive Agens ist, hängt sowohl vom Substrat, dem Acylderivat als auch dem Lösungsmittel ab. Nach der Abgabe eines Protons rearomatisiert das vorläufige Endprodukt 7. Die Lewis-Säure ist weiterhin am Carbonylsauerstoff koordiniert. Die Hydrolyse ist also im letzten Schritt als Reinigungsschritt zu sehen und setzt das Keton 8 frei. Als Lösungsmittel für die Reaktion dienen in der Regel die Aromaten im Überschuss selber. Es finden aber auch Nitrobenzol, Nitromethan oder bei niedrigen Temperaturen Dichlormethan Verwendung.[5][6]
Benzolderivate[Bearbeiten | Quelltext bearbeiten]
Durch die häufig hohen sterischen Anforderungen des Acylhalogenid-Lewissäuren-Komplexes weist die Friedel-Crafts-Acylierung eine hohe Regioselektivität auf, was bei Umsetzung einfach substituierter Benzolderivate zum para-Produkt führt. Desaktivierend substituierte Aromaten werden nach Friedel-Crafts nicht acyliert. Dementsprechend sind Mehrfach-Acylierungen bei dieser Reaktion nicht zu erwarten. Diese Eigenschaften machen die Friedel-Crafts-Acylierung synthetisch wertvoll gegenüber der Friedel-Crafts-Alkylierung.
Varianten[Bearbeiten | Quelltext bearbeiten]
Die Bedeutung der Reaktion wird durch die Tatsache, dass auch Carbonsäureanhydride und Carbonsäuren in Polyphosphorsäure geeignete Acylierungsmittel sind, noch größer. Durch die Aufeinanderfolge von Friedel-Crafts-Acylierung und Wolff-Kishner-Reaktion oder Clemmensen-Reduktion sind auch alkylsubstituierte Aromaten synthetisch zugänglich. Einen Spezialfall der Reaktion stellt die Gattermann-Koch-Synthese dar.
Neuere Entwicklungen[Bearbeiten | Quelltext bearbeiten]
Es gibt neuere Varianten,[7] welche auf den Edukteinsatz von halogenhaltigen Lewissäuren oder Protonensäuren verzichten und die Reaktion in Kontakt mit unterschiedlichen Feststoffen ablaufen lassen. Als besonders vorteilhaft zeigte sich die Verwendung von Zinkoxid.[8] Mit sowohl aktivierten als auch (schwach) deaktivierten Aromaten wie Chlorbenzol konnten bei milden Reaktionsbedingungen (Raumtemperatur) und kurzen Reaktionszeiten (einige Minuten) in vielen Fällen hohe Umsätze und Ausbeuten erzielt werden. Die Umsetzung wurde lösemittelfrei durchgeführt. Das Zinkoxid, das unterstöchiometrisch einsetzbar ist, konnte wiedergewonnen und mehrfach eingesetzt werden. Eine wässrige Aufarbeitung war nicht nötig. Ein simpler nicht-protischer Auszug war ausreichend, um in den meisten Fällen ohne weitere Aufreinigung eine hohe Produktreinheit zu erzielen. Der Mechanismus wurde nicht untersucht. Es ist denkbar, dass intermediär Zinkchlorid als Lewissäure entsteht, allerdings läuft die Reaktion auch auf Graphit anstelle des Metalloxids ab.[9] Mit Carbonsäureanhydriden anstelle der Chloride versagte die Reaktion. Eine Reihe anderer Metalloxide, darunter Aluminiumoxid, zeigte sich als deutlich unterlegen oder unbrauchbar. Gute Ergebnisse wurden mit Eisen(III)-oxid und Eisen(III)-sulfat erzielt.[10]
In Hexafluorisopropanol als Lösungsmittel vollzieht sich die Reaktion elektronenreicher Aromaten bei 25 °C, ohne dass weitere Zusätze nötig wären.[11]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Siegfried Hauptmann: Organische Chemie. 2., durchgesehene Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 354.
- ↑ D. E. Pearson, Calvin A. Buehler: Friedel-Crafts Acylations with Little or No Catalyst. In: Synthesis. Nr. 10, 1972, S. 533–542, doi:10.1055/s-1972-21912.
- ↑ Volker Vossius: Beiträge zur innermolekularen Acylierung nach Friedel-Crafts. München 1955.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie. 5. Auflage. de Gruyter Verlag, Berlin 2015, ISBN 978-3-11-030559-3, S. 391.
- ↑ T. Laue, A. Plagens: Namens- und Schlagwort-Reaktionen der Organischen Chemie. (= Teubner Studienbücher Chemie). 5. Auflage. 2006, ISBN 3-519-33526-3, S. 129.
- ↑ Z. Wang: Comprehensive Organic Name Reactions and Reagents. Vol. 1, Wiley, 2009, ISBN 978-0-471-70450-8, S. 1126.
- ↑ OC Portal.
- ↑ Mona Hosseini Sarvari, Hashem Sharghi: Reactions on a Solid Surface. A Simple, Economical and Efficient Friedel−Crafts Acylation Reaction over Zinc Oxide (ZnO) as a New Catalyst. In: The Journal of Organic Chemistry. Band 69, Nr. 20, 2004, S. 6953–6956, doi:10.1021/jo0494477.
- ↑ Mitsuo Kodomari, Yoshitada Suzuki, Kouji Yoshida: Graphite as an effective catalyst for Friedel–Craftsacylation. In: Chemical Communications. Nr. 16, 1997, S. 1567–1568, doi:10.1039/A703947F.
- ↑ John O. Morley: Aromatic acylations catalysed by metal oxides. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 5, 1977, S. 601–605, doi:10.1039/P29770000601.
- ↑ R. H. Vekariya, J. Aubé: Hexafluoro-2-propanol-Promoted Intermolecular Friedel–Crafts Acylation Reaction. In: Organic Letters. Nr. 15, 2016, S. 3534–3537, doi:10.1021/acs.orglett.6b01460.