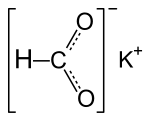
Kaliumformiat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumformiat | ||||||||||||||||||
| Summenformel | CHKO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,91 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−679,7 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Kaliumformiat ist das Kaliumsalz der Ameisensäure mit der Formel K(HCOO). Es ist eine farblose, zerfließliche Substanz in kristalliner, rhombischer Form. Die Dichte beträgt 1,91 g/cm3, der Schmelzpunkt liegt bei 167,5 °C. Kaliumformiat tritt als Zwischenprodukt im inzwischen technisch unbedeutenden Formiat-Pottasche-Verfahren zur Herstellung von Kaliumcarbonat auf. Der Namensbestandteil -formiat geht auf das lateinische Wort formica (Ameise) zurück.
Kaliumformiat wird als Flächenenteisungsmittel, beispielsweise auf Straßen und Flughäfen, eingesetzt und hat sich in einer Untersuchung des Finnish Environment Institute (SYKE) im Vergleich zu kochsalzhaltigen Auftaumitteln als verhältnismäßig umweltschonend erwiesen.[4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Kaliumformiat kann durch Salzbildungsreaktion aus Kaliumhydroxid und Ameisensäure hergestellt werden.
Ebenso ist die Synthese aus Kaliumcarbonat und Ameisensäure unter Entwicklung von Kohlendioxid möglich.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt Kaliumformiat bei Alfa Aesar, abgerufen am 26. März 2010 (Seite nicht mehr abrufbar).
- ↑ a b c Eintrag zu Kaliumformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2017. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Alternative de-icer found ( vom 27. September 2007 im Internet Archive), Pressemitteilung des Finnischen Umweltministeriums vom 2. Oktober 2004.
- ↑ T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates", in: Journal of Thermal Analysis and Calorimetry, 1975, 7 (1), S. 73–80 doi:10.1007/BF01911627

