Octanolacton
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
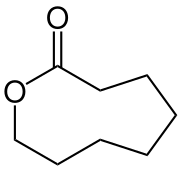
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Octanolacton | ||||||||||||
| Andere Namen |
2-Oxonanon | ||||||||||||
| Summenformel | C8H14O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 142,2 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Octanolacton ist eine chemische Verbindung aus der Stoffgruppe der Lactone.
Gewinnung[Bearbeiten | Quelltext bearbeiten]
Octanolacton kann auch durch Baeyer-Villiger-Oxidation von Cyclooctanon mit Peroxytrifluoressigsäure gewonnen werden[2] oder mit Bis(trimethylsilyl)peroxid in Gegenwart einer Lewissäure.[3] Eine weitere Reaktion zur Bildung des Lactons ist durch die intramolekulare Veresterung von ω-Hydroxyoctansäure durch Umsetzung mit p-Nitrobenzoesäureanhydrid und Scandiumtriflat in Acetonitril und THF.[4] Eine andere Synthese, die auf einem ähnlichen Anhydrid basiert, existiert ebenfalls.[5] Weitere Synthesemöglichkeiten sind die Umesterung des Ethylesters dieser Säure mit Zirconium(IV)-oxid bei 250 °C.[6] Eine durch Samarium(II)-iodid induzierte, radikalische Cyclisierungsreaktion mit einem anderen Edukt wurde ebenfalls publiziert.[7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Octanolacton hat eine hohe Ringspannung von über 10 kcal/mol.[8] Die thermodynamischen Eigenschaften von Octanolacton wurden detailliert untersucht, dabei wurde die Bildungsenthalpie von 434,3 kJ/mol bestimmt.[9]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Octanolacton kann durch enzymatische ringöffnende Polymerisation zu einem Polyester umgesetzt werden.[10][11][12]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Huisgen, H. Ott: Darstellung und Konfiguration von Heptanolid und Octanolid. In: Angewandte Chemie. Band 70, Nr. 10, 21. Mai 1958, S. 312–312, doi:10.1002/ange.19580701009.
- ↑ Seijiro Matsubara, Kazuhiko Takai, Hitosi Nozaki: Baeyer-Villiger Oxidation with Me 3 SiOOSiMe 3 under Assistance of SnCl 4 or BF 3 ·OEt 2. In: Bulletin of the Chemical Society of Japan. Band 56, Nr. 7, Juli 1983, S. 2029–2032, doi:10.1246/bcsj.56.2029.
- ↑ Kazuaki Ishihara, Manabu Kubota, Hideki Kurihara, Hisashi Yamamoto: Scandium Trifluoromethanesulfonate as an Extremely Active Lewis Acid Catalyst in Acylation of Alcohols with Acid Anhydrides and Mixed Anhydrides. In: The Journal of Organic Chemistry. Band 61, Nr. 14, 1. Januar 1996, S. 4560–4567, doi:10.1021/jo952237x.
- ↑ Junji Inanaga, Kuniko Hirata, Hiroko Saeki, Tsutomu Katsuki, Masaru Yamaguchi: A Rapid Esterification by Means of Mixed Anhydride and Its Application to Large-ring Lactonization. In: Bulletin of the Chemical Society of Japan. Band 52, Nr. 7, Juli 1979, S. 1989–1993, doi:10.1246/bcsj.52.1989.
- ↑ Hideyuki Kuno, Makoto Shibagaki, Kyoko Takahashi, Ichiro Honda, Hajime Matsushita: Lactonization of ω-Hydroxy Esters over Hydrous Zirconium(IV) Oxide. In: Chemistry Letters. Band 21, Nr. 4, April 1992, S. 571–574, doi:10.1246/cl.1992.571.
- ↑ Takanori Tabuchi, Kisa Kawamura, Junji Inanaga, Masaru Yamaguchi: Preparation of medium- and large-ring lactones. SmI2-induced cyclization of ω-(α-bromoacyloxy) aldehydes. In: Tetrahedron Letters. Band 27, Nr. 33, Januar 1986, S. 3889–3890, doi:10.1016/S0040-4039(00)83907-6.
- ↑ Kenneth B. Wiberg, Roy F. Waldron: Lactones. 2. Enthalpies of hydrolysis, reduction, and formation of the C4-C13 monocyclic lactones. Strain energies and conformations. In: Journal of the American Chemical Society. Band 113, Nr. 20, September 1991, S. 7697–7705, doi:10.1021/ja00020a036.
- ↑ V. N. Emel’yanenko, S. P. Verevkin, E. N. Stepurko, G. N. Roganov: Investigating the thermodynamic properties of lactones at various temperatures. In: Russian Journal of Physical Chemistry A. Band 85, Nr. 12, Dezember 2011, S. 2093–2102, doi:10.1134/S0036024411120065.
- ↑ Shiro Kobayashi, Hiroshi Uyama, Shuhei Namekawa, Hiroshi Hayakawa: Enzymatic Ring-Opening Polymerization and Copolymerization of 8-Octanolide by Lipase Catalyst. In: Macromolecules. Band 31, Nr. 17, 1. August 1998, S. 5655–5659, doi:10.1021/ma980396n.
- ↑ Andrzej Duda, Adam Kowalski, Stanislaw Penczek, Hiroshi Uyama, Shiro Kobayashi: Kinetics of the Ring-Opening Polymerization of 6-, 7-, 9-, 12-, 13-, 16-, and 17-Membered Lactones. Comparison of Chemical and Enzymatic Polymerizations. In: Macromolecules. Band 35, Nr. 11, 21. Mai 2002, S. 4266–4270, doi:10.1021/ma012207y.
- ↑ A Albertsson, R Srivastava: Recent developments in enzyme-catalyzed ring-opening polymerization☆. In: Advanced Drug Delivery Reviews. Band 60, Nr. 9, 10. Juni 2008, S. 1077–1093, doi:10.1016/j.addr.2008.02.007.