Tolfenaminsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tolfenaminsäure | |||||||||||||||||||||
| Andere Namen |
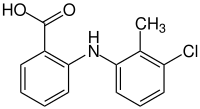
2-[(3-Chlor-2-methylphenyl)-amino]benzoesäure | |||||||||||||||||||||
| Summenformel | C14H12ClNO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 261,70 g·mol−1 | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Tolfenaminsäure ist ein Derivat der Anthranilsäure und gehört zur Gruppe der Fenamate. In der Medizin wird es als nichtsteroidales Antiphlogistikum (entzündungshemmendes Mittel) eingesetzt.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Tolfenaminsäure kann durch die Umsetzung des Kaliumsalzes der 2-Brombenzoesäure mit 3-Chlor-2-methylanilin bei 145 °C in NMP in Gegenwart von Kupfer(II)-acetat erfolgen.[5]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tolfenaminsäure tritt in zwei unterschiedlich gefärbten polymorphen Kristallformen auf. Die gelbe Kristallform zeigt einen Schmelzpunkt von 212,6 °C mit einer Schmelzenthalpie von 49 kJ·mol−1. Die weiße Kristallform schmilzt bei 211,0 °C mit einer Schmelzenthalpie von 41 kJ·mol−1.[1] Beide Kristallformen stehen monotrop zueinander. Das gelbe Polymorph ist die thermodynamisch stabilere Form. Beide Kristallformen bilden ein monoklines Kristallgitter. Die Raumgruppe ist bei der weißen Form P21/c, die der gelben Form P21/n.[6] Es handelt sich um Konformationspolymorphe.
Wirkungsprinzip
[Bearbeiten | Quelltext bearbeiten]Tolfenaminsäure ist ein Hemmer der sog. Cyclooxygenase, einem Enzym der Synthese von Prostaglandin. Infolge der Unterdrückung dieses Entzündungsstoffs wirkt es entzündungshemmend (antiphlogistisch), fiebersenkend (antipyretisch) und schmerzlindernd (analgetisch).
Kontraindikationen
[Bearbeiten | Quelltext bearbeiten]Das Mittel sollte nicht bei Schädigungen der Nieren, der Leber, des Herzens und bei Geschwüren und Blutungen im Magen-Darm-Kanal eingesetzt werden. Für Bluter ist es ebenfalls kontraindiziert.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Migea, Tolfedine, Clotam (Tobishi Shingaku)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Tolfenaminsäure bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e A. O. Surov, P. Szterner, W. Zielenkiewicz, G. L. Perlovich: Thermodynamic and structural study of tolfenamic acid polymorphs. In: J Pharm Biomed Anal. 50, 2009, S. 831–840; doi:10.1016/j.jpba.2009.06.045.
- ↑ a b Datenblatt Tolfenamic acid bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- ↑ Eintrag TOLFENAMIC ACID CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 5. Juli 2009.
- ↑ A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances -Synthesis, Patens, Applications-. 4. Auflage. Thieme Chemistry, Stuttgart 2001, ISBN 3-13-115134-X.
- ↑ J. S. Kaltenbronn, R. A. Scherrer, F. W. Short, E. M. Jones, H. R. Beatty, M. M. Saka, C. V. Winder, J. Wax, W. R. Williamson: Structure-activity relationships in a series of anti-inflammatory N-arylanthranilic acids. In: Arzneimittel-Forschung. Band 33, Nummer 4A, 1983, S. 621–627. PMID 6683967.
- ↑ K. V. Anderson, S. Larsen, B. Alhede, N. Gelting, O. Buchardt: Characterization of Two Polymorphic Forms of Tolfenamic Acid, N-(2-Methyl-3-chlorophenyl)anthranilic Acid: Their Crystal Structures and Relative Stabilities. In: J. Chem. Soc., Perkin Trans. 2. 1989, S. 1443–1447, doi:10.1039/P29890001443.