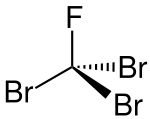
Tribromfluormethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tribromfluormethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CBr3F | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 270,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
2,765 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
106–107 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,525 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Tribromfluormethan ist eine chemische Verbindung des Broms aus der Gruppe der Halogenkohlenwasserstoffe.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Tribromfluormethan kann durch Reaktion von Tetrabrommethan mit Bromtrifluorid, Antimontrifluorid (auch zusammen mit Brom) oder Silber(I)-fluorid gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Tribromfluormethan ist eine klare farblose Flüssigkeit,[1] die unlöslich in Wasser ist.[2] Im festen Zustand hat die Verbindung eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62).[4]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Tribromfluormethan wird in der Synthese von organischen Verbindungen wie von Dibromfluormethyllithium verwendet, das mit einem Aldehyd oder Keton umgesetzt fluorierte Alkohole ergibt.[1] Es wurde auch zum Feuerlöschen eingesetzt.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j Datenblatt Tribromofluoromethane, 99% bei Sigma-Aldrich, abgerufen am 31. März 2016 (PDF).
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 516 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Thomas L. Gilchrist: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, ISBN 0-08-042704-9, S. 222 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Andrew N. Fitch, Jeremy K. Cockcroft: The structure of solid tribromofluoromethane CFBr3 by powder neutron diffraction. In: Zeitschrift für Kristallographie - Crystalline Materials. 202, 1992, doi:10.1524/zkri.1992.202.14.243.
- ↑ Mark Anthony Benvenuto: Industrial Chemistry For Advanced Students. Walter de Gruyter GmbH & Co KG, 2015, ISBN 978-3-11-035170-5, S. 115 (eingeschränkte Vorschau in der Google-Buchsuche).


