UDP-Glucose-4-Epimerase
Zur Navigation springen
Zur Suche springen
| UDP-Glucose-4-Epimerase | ||
|---|---|---|

| ||
| UDP-Glucose-4-Epimerase-Dimer (Mensch) nach PDB 1EK5 | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 348 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | NAD+ | |
| Bezeichner | ||
| Gen-Name | GALE | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.1.3.2, Isomerase | |
| Reaktionsart | Umlagerung | |
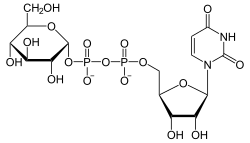
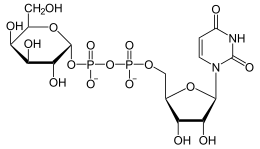
| Substrat | UDP-Galactose, UDP-N-Acetylgalactosamin | |
| Produkte | UDP-Glucose, UDP-N-Acetylglucosamin | |
| Vorkommen | ||
| Homologie-Familie | NAD-abhängige Epimerase | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2582 | 74246 |
| Ensembl | ENSG00000117308 | ENSMUSG00000028671 |
| UniProt | Q14376 | Q8R059 |
| Refseq (mRNA) | NM_000403 | NM_178389 |
| Refseq (Protein) | NP_000394 | NP_848476 |
| Genlocus | Chr 1: 23.8 – 23.8 Mb | Chr 4: 135.96 – 135.97 Mb |
| PubMed-Suche | 2582 | 74246
|
UDP-Glucose-4-Epimerase (Gen: GALE), auch UDP-Galactose-4-Epimerase, ist das Enzym, das die Umlagerung von UDP-Galactose zu UDP-Glucose und umgekehrt katalysiert. Diese Reaktion ist ein Teilschritt in der Verwertung von Galactose in vielen Lebewesen. Mutationen im GALE-Gen können zum Mangel an Epimerase und dieser zu Galaktosämie Typ 3 führen.[1]
Katalysiertes Gleichgewicht
[Bearbeiten | Quelltext bearbeiten]UDP-Glucose wird zu UDP-Galactose umgelagert und umgekehrt. Als alternative Substrate werden UDP-N-Acetylglucosamin und -galactosamin akzeptiert, was jedoch für den Stoffwechsel insgesamt keine Bedeutung hat.[2]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Biochemie und Pathobiochemie: Galactose-Stoffwechsel – Lern- und Lehrmaterialien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt Q14376
- ↑ Schulz JM, Ross KL, Malmstrom K, Krieger M, Fridovich-Keil JL: Mediators of galactose sensitivity in UDP-galactose 4'-epimerase-impaired mammalian cells. In: J. Biol. Chem. 280. Jahrgang, Nr. 14, April 2005, S. 13493–502, doi:10.1074/jbc.M414045200, PMID 15701638.