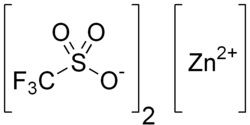
Zinktrifluormethansulfonat
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinktrifluormethansulfonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | ZnC2F6O6S2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 363,51 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zinktrifluormethansulfonat ist eine chemische Verbindung des Zinks aus der Gruppe der Sulfonate und Salz der Trifluormethansulfonsäure.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Zinktrifluormethansulfonat Es kann durch Reaktion von Trifluormethansulfonsäure mit Zink in Acetonitril oder mit Zinkcarbonat in Methanol hergestellt werden.[3][4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Zinktrifluormethansulfonat ist ein weißes, kristallines Pulver, das löslich in Wasser ist.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Zinktrifluormethansulfonat wird häufig als Lewis-Säure-Katalysator für eine Reihe von Reaktionen (zum Beispiel bei Silylierungen und der Biginelli-Reaktion[5]) verwendet.[6][7][8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Zinktrifluormethansulfonat, >98.0% bei TCI Europe, abgerufen am 14. September 2023.
- ↑ a b c Peter Ham: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester 2001, ISBN 978-0-471-93623-7, Zinc Trifluoromethanesulfonate, doi:10.1002/047084289x.rz023.
- ↑ Jean Lombard, Sophie Romain, Stéphane Dumas, Jérôme Chauvin, Marie‐Noëlle Collomb, Denis Daveloose, Alain Deronzier, Jean‐Claude Leprêtre: Tetranuclear Polypyridyl Complexes of Ru II and Fe II : Synthesis, Electrochemical, Photophysical and Photochemical Behaviour. In: European Journal of Inorganic Chemistry. Band 2005, Nr. 16, 2005, S. 3320–3330, doi:10.1002/ejic.200500106.
- ↑ E.J. Corey, Katsuichi Shimoji: Magnesium and zinc-catalyzed thioketalization. In: Tetrahedron Letters. Band 24, Nr. 2, 1983, S. 169–172, doi:10.1016/S0040-4039(00)81357-X.
- ↑ X. u. Hui, Wang Yan-Guang: A Rapid and Efficient Biginelli Reaction Catalyzed by Zinc Triflate. In: Chinese Journal of Chemistry. 21, 2003, S. 327, doi:10.1002/cjoc.20030210321.
- ↑ Huiling Jiang, Shizheng Zhu: Silylation of 1-alkynes with chlorosilanes promoted by Zn(OTf)2: an efficient way to the preparation of alkynylsilanes. In: Tetrahedron Letters. Band 46, Nr. 3, 2005, S. 517–519, doi:10.1016/j.tetlet.2004.10.175.
- ↑ Ronaldo Aloise Pilli, Luis Gustavo Robello: Zinc Triflate as Lewis Acid in Nucleophilic Addition to Cyclic N-Acyliminium Ions. In: ChemInform. Band 37, Nr. 4, 2006, doi:10.1002/chin.200604033.
- ↑ Tse-Lok Ho: Fiesers' Reagents for Organic Synthesis, Volume 28. Wiley, 2016, ISBN 978-1-118-94281-9, S. 567 (eingeschränkte Vorschau in der Google-Buchsuche).


