Kröhnke-Pyridin-Synthese
Die Kröhnke-Pyridin-Synthese ist eine Namensreaktion der organischen Chemie, die nach ihrem Entdecker, dem deutschen Chemiker Fritz Kröhnke (1903–1981), benannt wurde.[1] Sie dient der Synthese von Pyridinderivaten ausgehend von unsubstituiertem Pyridin. Die Reaktion erfolgt über mehrere Zwischenstufen, wobei unter anderem α,β-ungesättigten Ketone eingesetzt werden.
Übersichtsreaktion
Die Kröhnke-Pyridin-Synthese liefert Pyridinderivate unter Substitution dreier Wasserstoffatome der Ausgangsverbindung Pyridin. Die Substituenten R1, R2 und R3 sind organische Reste.
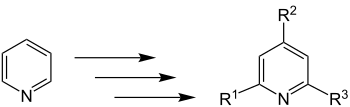
Beispielsweise kann es sich bei diesen organischen Resten um Methylgruppen handeln, wie die folgende Übersichtsreaktion zeigt. Allerdings müssen die im Zielmolekül gebundenen Reste nicht zwingend gleich sein.

Reaktionsmechanismus
Im Folgenden soll ein möglicher Reaktionsmechanismus für die Kröhnke-Pyridin-Synthese entsprechend der zweiten Übersichtsreaktion beschrieben werden. In diesem Beispiel sind R1, R2 und R3 Methylreste und damit das Reaktionsprodukt 2,4,6-Collidin.[2][3][4]
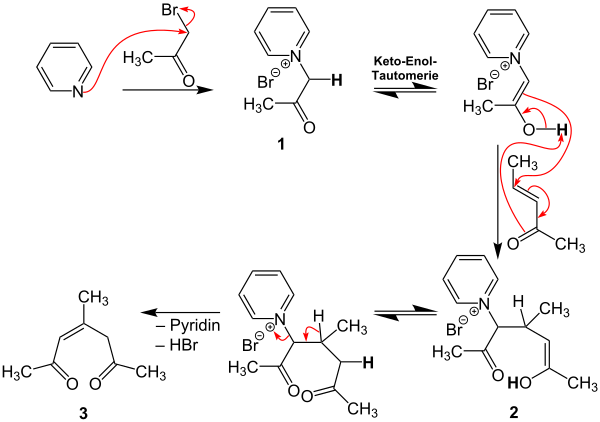
Zunächst reagiert Pyridin mit Bromaceton zur Zwischenstufe 1. Auf eine Keto-Enol-Tautomerie folgt dann die Addition von (E)-3-Penten-2-on und es entsteht Zwischenstufe 2. Nach einer weiteren Keto-Enol-Tautomerie werden Pyridin und HBr abgespalten, so dass Zwischenstufe 3 gebildet wird. Die Reaktion läuft in Gegenwart eines Gemisches aus Ammoniumacetat und Essigsäure ab, welche in folgendem Gleichgewicht miteinander stehen:
Auf diese Weise wird Ammoniak für den nächsten Reaktionsschritt geliefert:
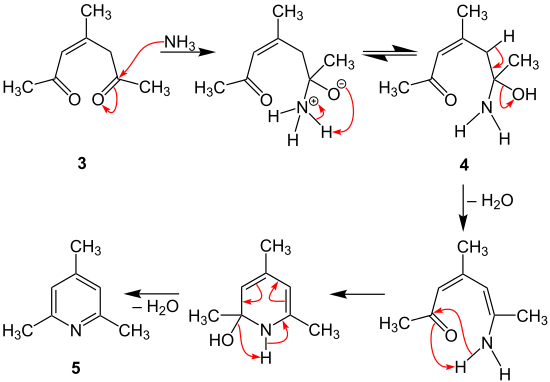
Zuerst wird Ammoniak an die Zwischenstufe 3 addiert und über eine Tautomerie entsteht Zwischenstufe 4. Nach der Wasserabspaltung, kommt es zum Ringschluss. Schließlich wird unter Aromatisierung erneut Wasser abgespalten und 2,4,6-Trimethylpyridin (5) gebildet.
Einzelnachweise
- ↑ Wilfried Zecher, Fritz Kröhnke: Eine neue Synthese substituierter Pyridine, I. Grundzüge der Synthese. In: Chemische Berichte. Band 94, Nr. 3, 1961, S. 690–697, doi:10.1002/cber.19610940317.
- ↑ Jie Jack Li: Name reactions: A collection of detailed mechanisms and synthetic applications. 5. edition Auflage. Springer, Cham 2014, ISBN 978-3-319-03979-4, S. 413–414, doi:10.1007/978-3-319-03979-4.
- ↑ Bradford P. Mundy; Michael G. Ellerd; Frank G. Favaloro: Name reactions and reagents in organic synthesis. 2. edition Auflage. Wiley, Hoboken (N.J.) 2005, ISBN 0-471-73987-1, S. 304.
- ↑ Zerong Wang: Comprehensive organic name reactions and reagents Volume 2. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28663-0, S. 1695–1698.
