Kernpore
| Kernpore | ||
|---|---|---|
| ||
| Schemazeichnung | ||
| Masse/Länge Primärstruktur | 120 Megadalton | |
| Transporter-Klassifikation | ||
| TCDB | 9.A.14 | |
| Bezeichnung | NPC family | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten | |
| Übergeordnet |
|---|
| Zellkern |
| Gene Ontology |
| QuickGO |
Kernporen (Abk. NPC, von englisch nuclear pore complex) sind Proteinkomplexe in der Kernhülle der Zellkerne von eukaryotischen Zellen. Die Kernhülle besteht aus einer Doppelmembran. Kernporen gehen durch beide Membranen hindurch, sie fungieren somit als „Tore“ und erlauben den Transport von bestimmten Molekülen in den Zellkern oder aus ihm heraus.
In der Kernhülle einer Wirbeltierzelle gibt es etwa 2.000 Poren.
Struktur
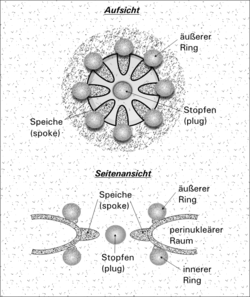
Der Rand der Pore besteht außen wie innen aus je acht Proteinkomplexen. Speichenartige Fortsätze ragen zum Mittelpunkt der Pore, wo ein Zentralgranulum sitzt, das ebenfalls einen Ribonukleoproteinkomplex darstellt.
Die Pore enthält einen Kanal, der aus einem 3D-Netzwerkgeflecht aus FG-Wiederholungen aufgebaut ist (F = Phenylalanin; G = Glycin), durch die Wasser ungehindert diffundieren kann.



Funktion
Kernporen katalysieren den passiven oder aktiven Transport von Proteinen, RNA, Ribonukleotid-Protein-Komplexen und kleinen Molekülen durch die Kernmembran.
Passiver Transport
Kleine Moleküle bis ca. 5.000 Da (Dalton) können frei durch die Kernpore diffundieren. Moleküle von etwa 17.000 Da benötigen bereits zwei Minuten für die Passage. Größere Teilchen mit einem Durchmesser von bis zu 2 nm oder 40.000 Da können die Kernporen nicht selbständig passieren.
Transport von mRNA aus dem Zellkern
Bei einer erhöhten Transkriptionsrate, z. B. bei Zellen, die viele Proteine produzieren, ist auch die Zahl der Kernporen erhöht, da die Transkription zwar im Zellkern, die Translation jedoch außerhalb des Zellkerns erfolgt und jedes fertige mRNA-Molekül daher den Zellkern verlassen muss.
Zunächst bindet das Protein nukleärer RNA-Exportfaktor 1 an den RNA-exon junction complex (EJC). Dieses Aggregat bindet nun andererseits an den Export-Rezeptor des NPC. Alles zusammen wird als export competent complex bezeichnet. Die Bewegung dieses Komplexes durch die Pore erfordert Energie, die in Form von GTP bereitgestellt wird. Am anderen Ende dissoziieren die genannten Komplexe wieder in ihre Teilkomplexe.[1]
Import von Proteinen
Der umgekehrte Transport von Proteinen in den Zellkern erfolgt nur, wenn das Protein eine Kernlokalisationssequenz besitzt. Das ist eine aus wenigen Aminosäuren bestehende Peptidsequenz. Benötigt werden außerdem bestimmte Transportmoleküle (Importine), die den Transport einleiten.
Weblinks
- Michael Rout and Brian Chait explain how they resolved the structure of the nuclear pore complex, Nature Online video streaming archive
- Eintrag in der CORUM-Datenbank
- Emily Velasco (Text); Valerie Altounian, C. J. Bley, S. Petrovic (Graphik): Decoding the Nuclear Pore Complex of the Cell, Atom by Atom. Auf: SciTechDaily vom 10. Juni 2022 (mit Animation).
Einzelnachweise
- ↑ G. Joshi-Tope/reactome: Transport of Mature Transcript to Cytoplasm - doi:10.3180/REACT_1281.1