Nickeloxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
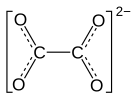
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nickeloxalat | |||||||||||||||
| Andere Namen |
Nickel(II)-oxalat | |||||||||||||||
| Summenformel | NiC2O4 | |||||||||||||||
| Kurzbeschreibung |
grün-weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,70 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Nickeloxalat ist eine chemische Verbindung des Nickels aus der Gruppe der Carbonsäuresalze.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]
Nickeloxalat kann durch Reaktion von Nickel(II)-salzlösungen mit Oxalsäure, oder besser einem Alkalimetalloxalat, gewonnen werden, wobei das Dihydrat entsteht.[5][6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Nickeloxalat ist als Dihydrat ein grünlich-weißer Feststoff, der praktisch unlöslich in Wasser ist.[1] Es kommt in zwei verschiedenen Kristallstrukturen vor. Die metastabilen β-Form besitzt eine orthorhombischen Kristallstruktur, die α-Form besitzt eine monokline Kristallstruktur. Durch Erhitzung können diese ab etwa 150 °C in das Anhydrat umgewandelt werden,[5] wobei die Kristallwasserabgabe nicht vollständig ist.[7] Dieses zersetzt sich ab etwa 280 °C[8] zu Nickel, Nickel(II)-oxid und hauptsächlich Kohlendioxid.[9][10][11] Das Anhydrat hat wie andere Metalloxalatanhydrate β-MeC2O4 eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[12]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Nickeloxalat wird als Zwischenprodukt zur Herstellung von Nickel und Nickel(II)-oxid (z. B. aus Erzen und zum Recycling von Batterien) verwendet.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Nickeloxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Nickel oxalate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Nickel(II) oxalate dihydrate, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 27. Juni 2016 (PDF).
- ↑ a b Wolfgang Hummel: Chemical Thermodynamics of Compounds and Complexes of U, Np, Pu, Am, Tc, Se, Ni and Zr With Selected Organic Ligands. Elsevier, 2005, ISBN 978-0-08-045752-9, S. 190 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ronald Rich: Inorganic Reactions in Water. Springer, 2007, ISBN 978-3-540-73962-3, S. 243 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. Małecka, A. Małecki, E. Drożdż-Cieśla, L. Tortet, P. Llewellyn, F. Rouquerol: Some aspects of thermal decomposition of NiC2O4·2H2O. In: Thermochimica Acta. Band 466, Nr. 1–2, 30. Dezember 2007, S. 57–62, doi:10.1016/j.tca.2007.10.010.
- ↑ B. Delmon, P. Grange, P.A. Jacobs, G. Poncelet: Preparation of Catalysts V Scientific Bases for the Preparation of Heterogeneous Catalysts. Elsevier, 1991, ISBN 978-0-08-087919-2, S. 172 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Boris V. L'vov: Thermal Decomposition of Solids and Melts New Thermochemical Approach to the Mechanism, Kinetics and Methodology. Springer Science & Business Media, 2007, ISBN 978-1-4020-5672-7, S. 223 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Xiao Ming Fu, Zai Zhi Yang: Preparation of Spherical NiO Nanoparticles by the Thermal Decomposition of NiC2O4 2H2O Precursor in the Air. In: Advanced Materials Research. 228–229, 2011, S. 34, doi:10.4028/www.scientific.net/AMR.228-229.34.
- ↑ B.-R. Shen, H. Shen, Y.-X. Pan, T.-F. Chen, X.-E. Cai: The Thermal Decomposition of NiC2O4·2H2O: An In situ TP-XRD and TGA/FT-IR Study. In: Zeitschrift für Physikalische Chemie. Band 215, Nr. 11/2001, 1. Januar 2001, doi:10.1524/zpch.2001.215.11.1413 (researchgate.net).
- ↑ Andrzej Koleżyński, Bartosz Handke, Ewa Drożdż-Cieśla: Crystal structure, electronic structure, and bonding properties of anhydrous nickel oxalate. In: Journal of Thermal Analysis and Calorimetry. 113, 2013, S. 319, doi:10.1007/s10973-012-2844-y.
- ↑ Nagaiyar Krishnamurthy, Chiranjib Kumar Gupta: Extractive Metallurgy of Rare Earths, Second Edition. CRC Press, 2015, ISBN 978-1-4665-7638-4, S. 665 (eingeschränkte Vorschau in der Google-Buchsuche).



