Benutzer:Hennix/Baustelle
| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Allgemeines | ||||||||
| Name | Hennix/Baustelle | |||||||
| Andere Namen |
| |||||||
| Summenformel | C6N4 | |||||||
| Kurzbeschreibung |
farblose kristalline Verbindung | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 128,01 g·mol−1 | |||||||
| Aggregatzustand |
fest | |||||||
| Schmelzpunkt |
199 °C | |||||||
| Siedepunkt |
223 °C | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
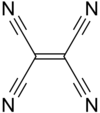
Tetracyanoethen (Kurzform: TCNE) ist eine farblose, hygroskopische und nach Blausäure riechende organische Verbindung. Sie lässt sich vom Ethen ableiten, wobei alle Wasserstoffatome durch Cyanogruppen ersetzt sind.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
TCNE wird aus Malonsäuredinitril über einen Kaliumbromid-Dibrommalonsäuredinitril-Komplex als Zwischeprodukt synthetisiert. Dabei bilden im ersten Reaktionsschritt Brom, Kaliumbromid und Malonsäuredinitril jenen Komplex. Dieser wird anschließend getrocknet und mit Kupferpulver zu TCNE umgesetzt.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
unter anderem Kristallstruktur (wenn vorhanden), thermodynamische Daten, ...
Da die Kohlenstoffatome sp2- beziehungsweise sp-hybridisiert sind, liegt das Molekül zweidimensional planar vor.

Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
unter anderem Reaktionen, ...
Durch den -I- und -M-Effekt, welchen die vier Cyanogruppen ausüben, herrscht an der Doppelbindung Elektronenmangel, was TCNE zu einem guten Elektronenakzeptor macht und die oxidierenden Wirkung erklärt.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Aufgrund der Planarität und der oxidierenden Wirkung wird TCNE bei der Herstellung organischer Supraleiter verwendet. Dabei nutzt man die Eigenschaft, dass es einzelne Elektronen eines Donators aufnimmt. Die entstehende Charge-Transfer-Komplexe werden manchmal auch als Bechgaard-Salze bezeichnet.
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
beim Menschen, bei Pflanzen und Tieren
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Toxikologie, Handhabung, Grenzwerte
Es ist darauf zu achten, dass TCNE bei Raumtemperatur an feuchter Luft langsam giftigen Cyanwasserstoff freisetzt. Direkter Kontakt mit der Haut sollte zudem vermieden werden.[2]
Nachweis[Bearbeiten | Quelltext bearbeiten]
Analysemethoden
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Tetracyanoethylene bei Organic Syntheses

![{\displaystyle \mathrm {4\ H_{2}C(CN)_{2}\ {\xrightarrow[{H_{2}O,\ \Delta }]{8\ Br_{2},\ KBr}}\ KBr\ [Br_{2}C(CN)_{2}]_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7044137f7b14ff43d1f027bb49fdeba9cd473639)
![{\displaystyle \mathrm {KBr\ [Br_{2}C(CN)_{2}]_{4}\ {\xrightarrow[{-KBr,\ CuBr_{2}}]{Cu,\ \Delta }}\ (CN)_{2}C=C(CN)_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ac3dddfe92acc7d2899f4bb5beed085f607f858)